Повідомлення
про захист дисертації на здобуття наукового ступеня
кандидата біологічних наук
Захист дисертації відбудеться 25 січня 2016 року о 14 годині на засіданні
спеціалізованої вченої ради Д 26.240.01 в Інституті біохімії ім. О.В.
Палладіна НАН України за адресою: 01030, Київ, вул. Леонтовича, 9.
Прізвище, ім'я, по батькові здобувача – Коломієць Оксана Валеріївна
Посада здобувача і повна назва установи, де він працює – молодший науковий співробітник відділу біохімії м'язів Інституту біохімії ім. О. В. Палладіна НАН України
Назва дисертації – «Трансмембранний обмін Са2+ в мітохондріях міометрія за дії оксиду азоту та калікс[4]аренів»
Шифр та назва спеціальності – 03.00.04 – біохімія
Шифр спеціалізованої ради – Д 26.240.01
Назва ВНЗ, наукової установи, її відомче підпорядкування, адреса і телефон – Інститут біохімії ім. О. В. Палладіна НАН України (01601, м. Київ, вул. Леонтовича, 9, тел. (044)234-59-74)
Науковий керівник – Костерін С. О., академік НАН України, доктор біологічних наук, професор, завідувач відділу біохімії м'язів (Інститут біохімії ім. О. В. Палладіна НАН України)
Офіційний опонент – Сибірна Н. О., доктор біологічних наук, професор, завідувач кафедри біохімії (Львівський національний університет імені Івана Франка)
Офіційний опонент – Компанець І. В., кандидат біологічних наук, доцент, доцент кафедри біохімії (Навчально-науковий центр «Інститут біології», Київський національний університет імені Тараса Шевченка)
НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
Інститут біохімії ім. О. В. Палладіна
КОЛОМІЄЦЬ ОКСАНА ВАЛЕРІЇВНА
УДК 577.352.4
ТРАНСМЕМБРАННИЙ ОБМІН Са2+ В МІТОХОНДРІЯХ МІОМЕТРІЯ ЗА ДІЇ ОКСИДУ АЗОТУ ТА КАЛІКС[4]АРЕНІВ
03.00.04 – біохімія
Автореферат
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Київ – 2016
Дисертацією є рукопис
Робота виконана в Інституті біохімії ім. О.В. Палладіна НАН України
Науковий керівник - доктор біологічних наук, професор,
академік НАН України
КОСТЕРІН Сергій Олексійович,
завідувач відділу біохімії м`язів,
заступник директора з наукової роботи
Інституту біохімії ім. О.В. Палладіна НАН України
Офіційні опоненти:
доктор біологічних наук, професор
СИБІРНА Наталія Олександрівна
завідувач кафедри біохімії
Львівського національного університету
імені Івана Франка
кандидат біологічних наук, доцент,
КОМПАНЕЦЬ Ірина Володимирівна
доцент кафедри біохімії
ННЦ «Інститут біології»
Київського національного університету
імені Тараса Шевченка
Захист дисертації відбудеться 25 січня 2016 року о 14 годині на засіданні
спеціалізованої вченої ради Д 26.240.01 в Інституті біохімії ім. О.В.
Палладіна НАН України за адресою: 01030, Київ, вул. Леонтовича, 9.
З дисертацією можна ознайомитись у бібліотеці Інституту біохімії
ім. О.В.Палладіна НАН України (Київ, вул. Леонтовича, 9).
Автореферат дисертації розісланий «__» грудня 2015 р.
Вчений секретар
спеціалізованої вченої ради
кандидат біологічних наук Карлова Н. П.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Гладенькі м'язи виконують фундаментальну роль у забезпеченні життєдіяльності організму, оскільки їхня скоротлива активність є необхідною для функціонування кровоносних та лімфатичних судин, дихальної системи, шлунково-кишкового тракту, сечостатевої системи, тощо. Матка займає важливе положення серед інших гладеньком'язових органів, що обумовлено тією специфічною функцією, яку вона виконує в організмі при виношуванні плоду та пологах.
Іони Са (Са2+) є універсальним вторинним месенжером, який має ключове значення у здійсненні контролю скорочення гладеньких м'язів, оскільки зростання внутрішньоклітинної концентрації Са2+ є лімітуючою ланкою у спряженні між збудженням та скороченням міоцитів. Са2+-гомеостаз забезпечується узгодженим функціонуванням субклітинних Са2+-транспортувальних систем (каналів, помп та обмінників), які обумовлюють транспортування катіону через плазматичну мембрану та мембрани внутрішньоклітинних органел, що виконують функцію депо Са2+, а саме саркоплазматичного ретикулума і мітохондрій (МХ) [Santo-Domingo J.etal., 2009; Костюк П.Г. та. ін., 2010].
Порушення Са2+-гомеостазу у гладеньком'язових клітинах (ГМК), як правило, є наслідком дисфункції Са2+-транспортувальних систем [KosterinS.A. etal., 1994]. Отже, пошук та вивчення біохімічних властивостей ендо- та екзогенних речовин, які б мали змогу спрямовано впливати на активність цих систем в субклітинних структурах ГМК, в тому числі і матки (міометрій), є важливим для їхнього подальшого практичного використання з метою корекції порушень контрактильної функції гладеньких м’язів.
Серед ендогенних сполук – можливих регуляторів Са2+-гомеостазу – значну увагу дослідників привертає оксид азоту (NO). Здатністьрозслабляти гладенькі м’язи зумовлює інтерес до використання донорів цієї сполуки в акушерсько-гінекологічній практиці. Але шляхи реалізації функціональної активності NOв матці вивчено недостатньо, що є актуальною науковою проблемою. Біохімічною основою міорелаксуючого ефекту NOможе бути його безпосередній вплив на субклітинні системи транспортування Са2+ в міоциті, наслідком чого є зниження концентрації катіону в міоплазмі і гальмування Са2+-залежної скоротливої активності міометрія [Garfield R.E.etal., 1998;Данилович Ю.В., 2001; Buxton I.L., 2004; Ковалев И.В. и пр., 2004; Данилович Ю.В., 2012].
Поряд з дослідженнями біохімічних властивостей ендогенних регуляторів транспортування Са2+ в ГМК важливим є пошук низькомолекулярних малотоксичних і селективних щодо певних катіон-транспортувальних систем екзогенних сполук з метою їхнього подальшого застосування як фармакологічних агентів. Протягом останніх років активну увагу дослідників привертають калікс[4]арени – циклічні олігомери фенолу, які володіють широким спектром біологічної активності та мають низьку токсичність. Важливо, що деякі калікс[4]арени виступають ефективними модуляторами субклітинних катіон-транспортувальних протеїнів міоцитів матки [Лабинцева Р.Д. та ін., 2007; Бевза О.В. та ін., 2013; Veklichetal., 2014]. Зазначені речовини є перспективними щодо подальшого дослідження їхнього впливу на Са2+-транспортувальні системи ГМК [Шликов С.Г. та ін., 2007; Лабинцева Р.Д. та ін., 2007; Стид Дж.В. и пр., 2007; Атамась Л.І. та ін., 2009].
МХ відіграють важливу роль в процесах Са2+-сигналізації, виконуючи функцію високоефективного Са2+-депо, внаслідок їхньої спроможності акумулювати та вивільняти значні кількості цього катіону. Тому МХ здатні впливати на амплітуду та часові характеристикивнутрішньоклітинного Са2+-сигналу. Акумуляція Са2+ МХ забезпечується передусім функціонуванням Са2+-уніпортера внутрішньої мембрани, тоді як зниження концентрації Са2+ в матриксі пов’язане із функціонуванням систем Са2+/Na+- і Са2+/Н+-обміну [Gunter T.E.etal., 1990; Szabadkai G. etal., 2009; Костюк П.Г. та ін., 2010].
Хоча існують значні досягнення у з'ясуванні біохімічних, біофізичних та функціональних властивостей Са2+-уніпортера МХ, інформація щодо його регуляції фізіологічними сполуками та потенційними фармакологічними агентами є доволі обмеженою і стосується, переважно, серцево-судинної системи [Акопова О.В. та ін., 2005; Ghafourifar P.etal., 2005, Santo-Domingo J.etal., 2009; Hoppe U.C., 2010]. Відомості щодо впливу NO на системи трансмембранного обміну Са2+ в МХ міометрія в доступній нам літературі відсутні.
Відомо, що вивільнення Са2+ з МХ гладеньких м'язів забезпечується Са2+/Н+-обмінником, функціонування якого передбачається також і в міометрії [Курский М.Д. и пр., 1987]. Не виключено, що модуляторами Са2+/Н+-обмінника можуть бути калікс[4]арени, оскільки деякі з них впливають на транспорт іонів Са в МХ [Шликов С.Г. та ін., 2007].
Трансмембранний потенціал на внутрішній мітохондріальній мембрані (150 – 170 мВ) є фундаментальною характеристикою МХ, яка визначає їхню функціональну активність і є індикатором останньої [Костюк П.Г. та ін., 2010]. Тому вивчення впливу NOта калікс[4]аренів на цей показник є актуальним.
Отже, дослідження біохімічних властивостей трансмембранного обміну Са2+ в МХ (Са2+-уніпортер, Са2+/Н+-обмінник) та впливу на нього ендо- та екзогенних модуляторів (оксид азоту, вибрані калікс[4]арени) є важливим для пошуку специфічних та малотоксичних ефекторів відповідних транспортувальних систем з метою спрямованої регуляції концентрації Са2+ в матриксі МХ та в міоплазмі.
Зв'язок роботи з науковими програмами, планами, темами
Дисертація відповідає основному плану науково-дослідних робіт відділу біохімії м’язів Інституту біохімії ім. О.В. Палладіна НАН України (зав. – академік НАН України, професор, д.б.н. Костерін С.О.), проблема “Біохімія тварин та людини”: - тема № 5, № 0109U001589 “Вивчення біохімічних механізмів регуляції концентрації іонів Са в гладеньком’язових клітинах” (І кв. 2009 - ІV кв. 2013); - тема № 5, № 0114U003213 “Вивчення біохімічних механізмів спряження збудження та скорочення в гладеньком’язових клітинах” (І кв. 2014 - ІV кв. 2018).
Мета роботи: Метою роботи було вивчити трансмембранний обмін Са2+ в мітохондріях міометрія щурів та поляризацію їхньої мембрани за дії оксиду азоту та калікс[4]аренів.
Головні задачі:
1. Дослідити вплив нітросполук на енергозалежну акумуляцію іонів Са в МХ міометрія.
2. З'ясувати властивості системи Са2+/Н+-обміну в МХ міометрія та вивчити закономірності дії нітросполук та калікс[4]аренів на її активність.
3. Вивчити вплив нітросполук та калікс[4]аренів на поляризацію внутрішньої мембрани МХ міометрія.
Об'єкти дослідження: ГМК матки та ізольовані МХ міометрія.
Предмет дослідження: системи трансмембранного обміну Са2+ в МХ та поляризація внутрішньої мітохондріальної мембрани.
Методи дослідження: препаративної біохімії, спектрофотометрії, спектрофлюориметрії, протокової цитофлюориметрії, фотонної кореляційної спектроскопії, світлової, електронної та лазерної конфокальної мікроскопії, кінетичного та статистичного аналізу.
Наукова новизна одержаних результатів
Доведено, що Са2+-чутливий флюоресцентний зонд Fluo-4 AM є перспективним для вивчення змін вмісту Са2+ в ізольованих МХ міометрія. Із використанням зазначеного флюоресцентного зондапродемонстровано, що процес Mg-АТР2--залежного транспорту Са2+ в МХ за присутності сукцинату досягає з часом стану рівноваги та характеризується насиченням за субстратом переносу, константа активації за Са2+ відповідає концентрації іонів Са у збуджених міоцитах поблизу МХ. Енергозалежна акумуляція Са2+ у МХ ефективно пригнічується рутенієвим червоним, протонофором СССР та олігоміцином.
Вперше показано, що за дії нітросполук - нітропрусиду та нітриту натрію - спостерігається зростання енергозалежної акумуляції Са2+ в ізольованих МХ міометрія, яке опосередковується активацією саме Са2+-уніпортера внутрішньої мітохондріальної мембрани. В МХ міоцитів матки вперше знайдений NO.
Із використанням специфічних антитіл проти протеїну Letm1 вперше доведено, що в МХ міометрія саме цей протеїн відповідає за Са2+/Н+-обмін. Вивчено окремі властивості Са2+/Н+-обміну, а саме: кінетика ΔрН-індукованого виходу Са2+ задовольняє реакції першого порядку, функціонування Са2+/Н+-обмінника є зворотним, він активується за фізіологічних значень рН та здійснюється в стехіометрії 1:1. Процесу Na/Са2+-обміну в МХ міометрія не виявлено. Са2+/Н+-обмінник є нечутливим до дії нітросполук, але стимулюється калікс[4]аренами С-97, С-99 та амілоридом і пригнічується іонами Mg.
Доведена можливість застосування методу лазерної конфокальної мікроскопії та флюоресцентного потенціалчутливого зонду DіОС6(3) для візуалізації змін потенціалу МХ інтактних міоцитів матки. Вперше продемонстровано, що NO зумовлює помірне зменшення трансмембранного мітохондріального потенціалу в клітинах міометрія, тоді як калікс[4]арени С-97 та С-99 викликають транзієнтну поляризацію мітохондріальної мембрани.
Представлені результати мають принципове значення для розуміння ролі МХ у контролі Са2+-гомеостазу в ГМК матки та їхнього значення у забезпеченні спряження між збудженням та скороченням в міометрії.
Практичне значення одержаних результатів
Одержані дані можуть бути корисними для подальшого пошуку ефективних модуляторів функціональної активності МХ та Са2+-гомеостазу в ГМК. Зокрема, нітросполуки, що були досліджені, виявилися дієвими ефекторами енергозалежного накопичення іонів Са в МХ, а калікс[4]арени – системи Са2+/Н+-обміну в зазначених субклітинних структурах. Ці результати перспективні для подальшого скринінгу донорів NO та каліксаренів щодо їх специфічного, зворотного та афінного впливу на системи трансмембранного обміну Са2+ в МХ ГМК.
Із використанням Са2+-чутливого флюоресцентного зонда Fluo-4 AM та методів спектрофлюориметрії і протокової цитофлюориметрії розроблено методичний підхід для вивчення змін кількості Са2+ в ізольованих МХ міометрія. Застосування потенціал-чутливого флюоресцентного зонда DіОС6(3) та методу конфокальної мікроскопії дозволяє візуалізувати зміни потенціалу МХ інтактних міоцитів матки. Продемонстровано, що із використанням NO-чутливого флюоресцентного індикатора DAF можна легко ідентифікувати місця утворення оксиду азоту в клітині.
Одержані в роботі результати та окремі методичні підходи можна використати як у науковій практиці, так і в навчальному процесі.
Особистий внесок здобувача
Головна ідея та задачі дослідження були сформульовані науковим керівником – академіком НАН України, професором, д.б.н. Костеріним С.О. Розробка методик досліджень, аналіз та інтерпретація результатів, формування основних положень та висновків роботи, підготовка до друку статей проводилась у співпраці з науковим керівником та с.н.с., д.б.н. Даниловичем Ю.В.
Дисертанткою самостійно здійснено аналіз та узагальнення відповідних літературних даних, одержано суспензії міоцитів матки щурів та ізольованих мітохондрій, проведено експериментальні дослідження з використанням методів спектрофлюориметрії, протокової цитофлюориметрії, лазерної конфокальної мікроскопії та фотонної кореляційної спектроскопії (деякі з цих дослідів - у співпраці з колегами с.н.с., д.б.н. Даниловичем Ю.В. та н.с., к.б.н. Данилович Г.В.), а також проведені кінетичний та статистичний аналіз результатів.
Апробація результатів дисертації
Матеріали дисертації було представлено на VIII Міжнародній науково-технічній конференції «Актуальні питання біологічної фізики та хімії» (м. Севастополь, Україна, 2012), IX Міжнародній науково-технічній конференції «Актуальні питання біологічної фізики та хімії» (м. Севастополь, Україна, 2013), Міжнародній міждисциплінарній науковій конференції «Біологічно активні речовини та матеріали: фундаментальні і прикладні питання отримання і використання» (м. Новий Світ, Україна, 2013), Науковій конференції молодих вчених “Актуальні проблеми біохімії та біотехнології ” (Київ, Україна, 2013), III Всеукраїнській науковій конференції молодих вчених “Фізіологія: від молекул до організму” (Київ, Україна, 2013), Науковій конференції молодих вчених “Актуальні проблеми біохімії та біотехнології ” (Київ, Україна, 2014), XI Українському біохімічному Конгресі (Київ, Україна, 2014).
Публікації
За результатами дисертації опубліковано 14 робіт, з них 6 статей у фахових наукових журналах та 8 тез доповідей у матеріалах міжнародних та вітчизняних наукових конференцій.
Структура та обсяг роботи
Дисертаційна робота викладена на 136 сторінках машинописного тексту і складається з таких розділів: «Вступ», «Огляд літератури», «Матеріали та методи досліджень», «Результати та їх обговорення», «Заключний розділ», «Висновки», «Список використаних джерел», який містить 128 посилань. Роботу ілюстровано 42 рисунками та 1 таблицею.
ОСНОВНИЙ ЗМІСТРОБОТИ
Огляд літератури
Огляд літератури складається з двох підрозділів. Перший присвячено біохімічним механізмам регуляції концентрації Са2+ в ГМК, а саме особливостям функціонування систем пасивного та енергозалежного транспорту Са2+ на рівні субклітинних структур, зокрема МХ. У другому підрозділі охарактеризовано ендо- та екзогенні модулятори транспорту Са2+ в ГМК – оксид азоту та калікс[4]арени, їхню біологічну активність.
Матеріали та методи досліджень
Препарат ізольованих МХ одержували із міометрія невагітних самок щурів за допомогою методудиференційного центрифугування [Костерин С.А. и пр., 1985; Кандаурова Н.В., 2013]. Вміст протеїну у фракції МХ визначали за стандартним методом Bradford M.M. [BradfordM.M., 1976].Середнє його значення складало 2 мг/мл, а в пробі – 50 мкг/мл.
Навантаження МХ Са2+-чутливим флюоресцентним зондом Fluo-4 AM (Glycine, N - [4 - [6 - [(acetyloxy)methoxy] -2,7-difluoro-3-oxo-3H-xanthen-9-yl] -2- [2- [2- [bis [2- [(acetyloxy)methoxy] -2-oxoethyl] amino] -5-methylphenoxy] ethoxy] phenyl] -N- [2- [(acetyloxy)methoxy] -2-oxoethyl] -(acetyloxy)methyl ester; C51H50F2N2O23) у концентрації 2 мкМ проводили у середовищі, яке містило 10 мМ HEPES(рН 7,4; 37 оС), 250 мМ цукрозу, 0,1 % бичачий сироватковий альбумін протягом 30 хв при температурі 37 оС. Для покращення процесу навантаження барвник змішували із Pluronic F-127 (0,02 %) [Кандаурова Н.В., 2013].
Реєстрацію відносних значень рівня Са2+ в матриксі МХ міометрія, навантажених Fluo-4 AM (λзб = 490 нм, λфл = 520 нм), здійснювалиіз використанням флюориметричного методу на спектрофлюориметрі Quanta Master 40 РТІ (Канада). Середовище, із якого здійснювалась енергозалежна акумуляція Са2+ МХ, мало наступний склад [Костерин С.А. и пр., 1985; Кандаурова Н. В., 2013]: 20 мМ HEPES (рН 7,4; 37 оС), 250 мМ цукроза, 2 мМ калій-фосфатний буфер (рН 7,4; 37 оС), 3 мМ MgCl2, 3 мМ АТР, 5 мМ сукцинат натрію; концентрація Са2+ становила 20-80 мкМ. Під час вивчення енергозалежної акумуляції Са2+ в МХ рівень ендогенної флюоресценції кислотної форми Fluo-4 АМ, пов'язаний із наявністю в матриксі іонізованого Са за його відсутності у середовищі, позначали як базальний рівень флюоресценції (F0) і віднімали його від величини флюоресцентної відповіді, зумовленої акумуляцією Са2+ МХ (F). Тоді безрозмірне співвідношення (F–F0)/F0 буде відповідати загальноприйнятим відносним одиницям флюоресценції.
У випадку дослідження ΔрН-індукованого вивільнення іонів Са з МХ попередню енергозалежну акумуляцію Са2+ проводили протягом 5 хв, після чого аліквоту суспензії розводили в ізотонічному середовищі вивільнення Са2+ наступного складу: 20 мМ HEPES (рН 5,0-8,0; 37 оС), 250 мМ цукроза, 2 мМ калій-фосфатний буфер (рН 5,0-8,0; 37 оС), 5 мМ сукцинат натрія, 5 мкМ циклоспорин А. Концентрація Са2+ в середовищі вивільнення катіону становила 4 мкМ. Інтенсивність флюоресценції при дослідженні ΔрН-індукованого вивільнення Са2+ виражалась у відносних одиницях F/Fo, де Fo– початковий флюоресцентний сигнал при внесенні суспензії ізольованих МХ, навантажених Са2+, в середовище їхнього ізотонічного розведення, F – поточний флюоресцентний сигнал у відповідні проміжки часу реєстрації вивільнення Са2+ з МХ.
Суспензію ГМК матки невагітних самок щурів одержували із використанням колагенази і соєвого інгібітора трипсину за методом Молларда П. в модифікації [MollardP. etal., 1986; Бабич Л.Г. и пр., 1994]. Клітини зберігали в розчині Хенкса Б (на льоду) наступного складу, (мМ): NaCl – 136,9; KCl - 5,36; КН2РО4 - 0,44; NaHCO3 - 0,26; Na2НРО4 - 0,26; CaCl2 – 0,03; глюкоза – 5,5; HEPES (рН, 7,4; 37 оС) – 10. В 1 мл отриманої клітинної суспензії містилось в середньому 6,58.106 міоцитів; кількість життєздатних клітин, згідно результатів фарбування клітинного препарату превітальним барвником трипановим синім - 90-95 % від загальної кількості. Підрахунок загальної кількості і кількості життєздатних клітин проводили з використанням гемоцитометра (камери Горяєва).
Клітини для проведення конфокально-мікроскопічних досліджень (об’єм суспензії 100 мкл) іммобілізували 2 год на предметному склі, обробленому полі-L-лізином (200 мкл), при температурі 24 0С. Неприкріплені міоцити відмивали розчином Хенкса Б, після чого до іммобілізованих міоцитів додавали 100 мкл розчину Б, клітини обробляли відповідними барвниками і проводили подальші дослідження. Для візуалізації МХ був залучений флюоресцентний барвник MitoTracker Orange CM-H2TMRos у концентрації 200 нМ, а для візуалізації ядер клітин – 50 мкМ Hoechst 33342. Розподіл DiOC6(3) (3,3’-дигексилоксакарбоцианін йодид) в клітині спостерігали за концентрації 100 нМ (при вивченні зміни мембранного потенціалу) або 500 нМ (для дослідження колокалізації барвників) [Данилович Г.В. та ін., 2011]. Іммобілізовані міоцити навантажували NO-чутливим флюоресцентним зондом DAF-FM(C21H14F2N2O5, 4-Amino-5-methylamino-2′,7′-difluorescein, Diaminofluorescein-FM) в концентрації 10 мкМ. Забарвлення барвниками відбувалось протягом 15 хв (24 оС).
Просторовий розподіл флюоресцентних барвників у клітині вивчали на лазерному скануючому конфокальному мікроскопі LSM 510 META ( “Carl Zeiss”, Німеччина). Дослідження на конфокальному мікроскопі проводили у режимі Multi Track. Флюоресценцію Hoechst 33342 збуджували за допомогою лазера при довжині хвилі 405 нм, а реєстрували при довжині 420-480 нм; для збудження флюоресценції MitoTracker Orange CM-H2TMRos використовували лазер з довжиною хвилі 543 нм, а флюоресценцію реєстрували в діапазоні 560-615 нм. Збудження флюоресценції DiOC6(3) здійснювали при довжині хвилі 488 нм, а її реєстрацію – в діапазоні 505-530 нм. Збуджували флюоресценцію DAF-FMза 488 нм, а реєстрували флюоресцентний сигнал в діапазоні 505-530 нм. Вивчення кінетики розподілу флюоресцентних барвників у клітині проводили у режимі TimeSeries, а для кількісного аналізу застосовували функцію ROI (“RegionOfInterest”), яка дозволяє отримувати графік залежності усередненої інтенсивності флюоресценції виділеної області від часу.
Мембранний потенціал МХ інтактних клітин реєстрували також із використанням протокового цитофлюориметра CoulterEpicsXLTM («BeckmanCoulter», США) та зонда DiOC6(3) (100 нМ) [Данилович Г.В. та ін., 2011]. Виміри проводились в фізіологічному середовищі Хенкса Б (24 0С).
Кінетичний аналіз процесів транспорту Са2+ здійснювали з використанням стандартних методів біохімічної кінетики, описаних раніше [Варфоломеев С.Д. и пр., 1982; Келети Т., 1990]. Константу активації акумуляції іонів Са в МХ розраховували в координатах Лайнуівера-Берка. Початкову швидкість ΔрН-індукованого виходу іонів Са із МХ розраховували в напівлогарифмічних координатах. Коефіцієнт Хілла та константу активації ΔрН-індукованого виходу іонів Са із МХ за протонами (рНа) розраховували, використовуючи лінеаризовані координати Хілла.
Статистичні параметри лінеаризованих графіків (коефіцієнт кореляції, тощо) розраховували методом найменших квадратів. У випадку переважної більшості лінеаризованих графіків стандартне значення коефіцієнта кореляції R становило 0,9-0,99. Статистичну обробку отриманих результатів проводили загальноприйнятими методами з використанням t-критерію Стьюдента [Кокунин В.А., 1975; Данилович Ю.В., 2009]. Кінетичні та статистичні розрахунки проводили за допомогою стандартного програмного забезпечення MS Office Excell на персональному комп'ютері типу ІВМ РС/АТ.
Синтез каліксаренфосфонових кислот С-97 (5-біс (дигідроксифосфорил) метил-25,27-дипропоксикалікс[4]арен), С-99 (5,17-біс (дигідроксифосфонілметилол)-25,27-дипропоксикалікс[4]арен), С-107 (5,17-біс (фосфоно-2-піридилметил) аміно-11,23-ди-трет-бутил-26,28-дигідрокси-25,27-дипропоксикалікс[4]арен) та С-150 (25, 27-дипропоксикалікс[4]арен) був здійснений у відділі хімії фосфоранів Інституту органічної хімії НАН України. Структура калікс[4]аренів була підтверджена із використанням методів інфрачервоної спектроскопії та ядерного магнітного резонансу. Калікс[4]арени були люб’язно надані нам професором, член-кор. НАНУ Кальченком В.І.
Результати досліджень та їх обговорення
1. Енергозалежна акумуляція іонів Са в мітохондріях міометрія та вплив нітросполук на цей процес
З метою дослідження змін концентрації Са2+ в МХ нами було обрано ацетоксиметильний естер Са2+-чутливого флюоресцентного зонду Fluo-4 АМ. Попередньо було показано, що у присутності МХ вміст кислотної форми зонда зростає з часом як наслідок розщеплення його естерифікованої форми. При додаванні до МХ, що містили активну форму барвника, Са2+ у зростаючій концентрації флюоресцентний сигнал збільшується. Отже, Са2+-чутливий флюоресцентний зонд Fluo‑4 AM цілком можна використовувати для вивчення закономірностей трансмембранного обміну Са2+ в ізольованих МХ гладенького м’яза.
Відомо, що МХ міометрія в середовищі без АТР та Mg2+ нездатні накопичувати Са2+ [Костерин С.А., 1990; Костерин С.А. и пр.,1993]. Було встановлено, що за присутності Mg-АТР2- та сукцинату навантажені Fluo-4 АМ МХ ефективно накопичують Са2+ (80 мкМ) із стандартного інкубаційного середовища: це супроводжується зростанням рівня флюоресценції. За відсутності енергетичних субстратів і, відповідно, зменшення електричного потенціалу на внутрішній МХ мембрані, накопичення Са2+ було практично відсутнє.
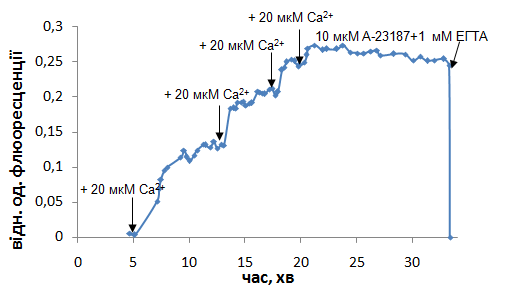
Рис. 1. Зміни інтенсивності флюоресцентної відповіді Fluo-4 АМ відображають здатність енергізованих мітохондрій міометрія накопичувати та ефективно стаціонарно утримувати іони Са2+, а також швидко звільняти його за присутності кальцієвого іонофора А-23187. Метод спектрофлюориметрії. Використано стандартне середовищеінкубації. Результати типового експерименту
Додавання Са2+ в зростаючих кількостях до попередньо навантажених Fluo-4 АМ МХ, які знаходились у середовищі із Mg-АТР2- та сукцинатом, таким чином, що кінцева концентрація катіона квантованостановила 20-40-60-80 мкМ, супроводжувалось збільшенням флюоресцентної відповіді із виходом на платовий рівень з часом (рис. 1). Посилення флюоресценції Fluo-4 АМ можна пояснити поступовою акумуляцією Са2+ у МХ, концентрація якого в середовищі послідовно збільшувалася. Ці органели мають здатність достатньо довго стаціонарно утримувати накопичений Са2+, про що свідчить факт стабільності флюоресцентної відповіді протягом не менше, ніж 10 хв (рис. 1). За цих умов встановлюється динамічна рівновага між транспортними процесами, які забезпечують накопичення (Са2+-уніпортер) та вивільнення (Са2+/Н+-обмінник) катіону МХ.
Надійна бар'єрна функція внутрішньої мембрани ізольованих МХ міометрія щодо Са2+ показана дослідами, в яких додавання аліквоти розчину Са2+-іонофору А-23187 (10 мкМ) разом із Са2+-хелатором ЕГТА (1 мМ) в умовах досягнення транспортувальним процесом стаціонарного рівня (80 мкМ Са2+ в середовищі інкубації) супроводжується різким падінням флюоресценції зонду, що свідчить про зниження концентрації катіону в МХ принаймні до базального рівня (рис. 1).
Акумуляція Са2+ вМХ характеризується насиченням за субстратом переносу, розрахована нами уявна константа активації транспортного процесу КСа для іонів Са сягає 53,9±6,9 мкМ (n=5), що відповідає концентрації Са2+ в просторі між саркоплазматичним ретикулюмом та МХ у клітині [Rizzuto R.etal., 2009]. Отже, в принципі, величина КСа знаходиться у межах фізіологічного діапазону концентрацій цього катіону, а її відносно високе значення підтверджує уявлення про те, що система енергозалежного транспорта Са2+ в МХ характеризується достатньо низькою спорідненістю до цього катіону [Костерин С.А., 1990; Костерин С.А. и пр., 1993].
В наступній серії експериментів було досліджено можливість накопичення Са2+ в умовах деенергізації МХ. В цих та подальших дослідах концентрація Са2+ в середовищі становила 80 мкМ.За умови дисипації градієнту Н+ при додаванніаліквоти розчину протонофоруcarbonylcyanidem-chlorophenylhydrazone(10 мкМ СССР) або блокування генерації протонного градієнту (при використанні 1 мкг/мл олігоміцину) накопичення Са2+ органелами знижувалось порівняно із контрольними експериментами (рис. 2). Одним з можливих пояснень цього явища є реверсне функціонування Ca2+/Н+ -обмінника. За присутності інгібітора Са2+-уніпортерарутенієвого червоного (10 мкМ RuR) накопичення катіона також істотно зменшувалось (рис. 2). Наявність нечутливго до RuR компонента транспорту Са2+ в МХ можна пояснити функціонуванням відмінних від уніпортера канальних структур та транслоказ, які, за певних умов, можливо, забезпечують накопичення іонів Са [Костюк П.Г. та ін., 2010].
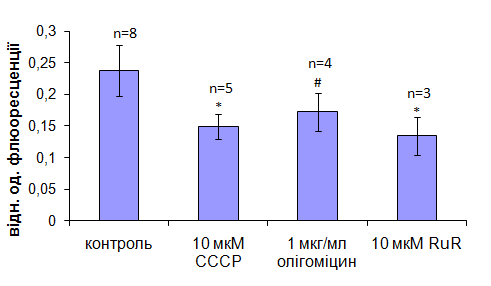
Рис. 2. Порівняльна оцінка впливу протонофору СССР, олігоміцину та рутенієвого червоного (RuR) на акумуляцію Са2+ мітохондріями міометрія. Концентрація іонів Са в робочому середовищі становила 80 мкМ. Метод спектрофлюориметрії, флюоресцентний зонд Fluo-4 АМ. М±m, */- зміни статистично вірогідні відносно контролю, Р≤0,05, # - Р<0,2. Використано стандартне середовище інкубації
В подальших дослідах було вивчено вплив нітросполук на енергозалежну акумуляцію іонів Са МХ. Слід зазначити, що джерела утворення NO в міоцитах матки практично не ідентифіковані. Це пов’язане, в тому числі, із коротким «часом життя» і високою реакційною здатністю NO.
Присутність Са2+-залежної ізоформи NO-синтази вМХ окремих тканин було доведено імуногістохімічними методами [Ghafourifar P.etal., 2005; Leite A.C.etal., 2010]. Використання сучасного флюоресцентного зонда DAFдозволяє безпосередньо швидко і надійно зареєструвати продукцію NO за його низьких концентрацій (2-5 нМ) в інтактних клітинах, а метод лазерної конфокальної мікроскопії – візуалізувати його утворення та, із використанням специфічних щодо МХ зондів, довести зв’язок біосинтезу NO саме із цими органелами [Nakatsubo N.etal., 1998; Lopez-Figueroa M.O.etal., 2000]. В наших експериментах використовували активну кислотну форму DAF (DAF-FM), яка безпосередньо взаємодіє з NO за присутності O2.
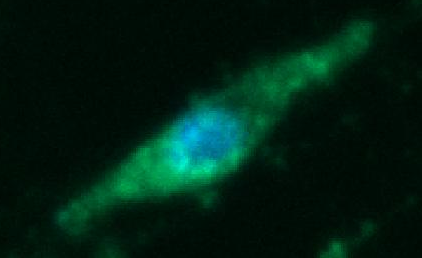
Рис. 3. Візуалізація окремих ділянок утворення NO різної інтенсивності в поодинокому міоциті матки із використанням флюоресцентного барвника DAF-FM (зелене забарвлення). Для ідентифікації локалізації ядра використаний Hoechst 33342 (синє забарвлення). Метод лазерної конфокальної мікроскопії
Проведеними дослідженнями встановлено, що в міоцитах матки спостерігається зелений флюоресцентний сигнал після передінкубації з DAF, що свідчить про базальну продукцію NO. Флюоресцентний зонд розподілявся в міоплазмі клітини, окреслюючи її контури та формуючи гетерогенні забарвлені ділянки та тяжі (рис. 3).
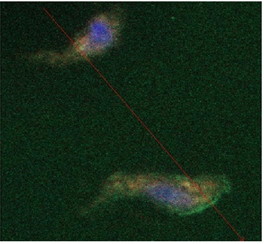
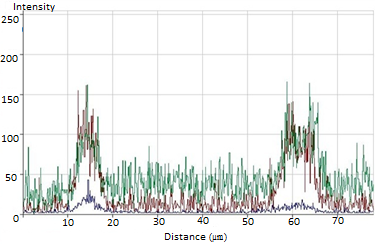
Рис. 4. Порівняння профілю розподілу в міоцитах матки флюоресцентних зондів, специфічних щодо мітохондрій (MitoTrackerOrangeCM-H2TMRos, бура крива, канал 1), оксиду азоту (DAF-FM, зелена крива, канал 2) та ядра (Hoechst 33342, синя крива, канал 3). Метод лазерної конфокальної мікроскопії
Додавання до міоцитів 0,1 мМ нітропрусиду натрію, донора NO, призводило до суттєвого зростання (майже у 3 рази) флюоресцентного сигналу. Інкубація клітин із зростаючими концентраціями N-нітро-L-аргініна - інгібітора Са2+-залежних ізоформ NO-синтаз - супроводжувалась дозозалежним зниженням інтенсивності флюоресценції DAF в середньому на 20 % (0,1 мМ N-нітро-L-аргінін) та 40 % (0,2 мМ N-нітро-L-аргінін). Ці результати свідчать про специфічність відповіді DAF щодо NO. Є всі підстави вважати, що DAF є оптимальним NO-чутливим флюоресцентним барвником для детекції NO в інтактних міоцитах матки.
Було також продемонстровано колокалізацію специфічного щодо МХ зонда MitoTracker Orange CM-H2TMRos, який накопичується лише в енергізованих органелах, та NO-чутливого барвника DAF (рис. 4). Комп’ютерний аналіз довільно обраного поза ядром клітинного зрізу показав тотожний розподіл обох флюоресцентних барвників.
Продукція NO в МХ інтактних міоцитів маткиможе свідчити про можливий вплив оксиду азоту на Са2+-транспортувальні процеси в цих органелах.
При дослідженні впливу NO на процес акумуляції іонів Са в МХ клітин міометрія як нітросполуки – донори NOбуло застосовано нітропрусид (SNP) та нітрит натрію (SN). Встановлено, що попередня інкубація МХ з нітросполуками (100 мкМ) протягом 15 хв призводила до суттєвого зростання акумуляції Са2+ органелами. Так, SNP посилював транспорт Са2+ приблизно в 1,6 рази (рис. 5). Вплив SN виявився дещо менш ефективним.
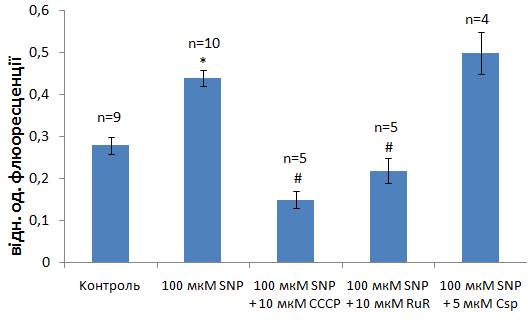
Рис. 5. Вплив модифікаторів трансмембранного обміну Са2+ (протонофору СССР, рутенієвого червоного (RuR)та циклоспорину А (Csp)) в мітохондріях міометрія на енергозалежний транспорт катіону в умовах активуючого впливу нітропрусиду натрія (SNP). Метод спектрофлюориметрії, флюоресцентний зонд Fluo-4 АМ. M±m; */ - зміни достовірні відносно контролю, Р≤0,05;#/- відносно дії 100 мкМ нітропрусиду натрія, Р≤0,05. Використано стандартне середовище інкубації
З метою доведення ролі Са2+-уніпортера в досліджуваному процесі нами було використано протонофор СССР та полікатіон – антагоніст Са2+ RuR. Встановлено, що 10 мкМ СССР та RuR ефективно пригнічували акумуляцію Са2+ в МХ за присутності SNP. Водночас, специфічний інгібітор пори перехідної проникності 5 мкМ циклоспорин А (Csp А) майже не впливав на активоване SNP енергозалежне накопичення Са2+ МХ (рис. 5), хоча при цьомуі спостерігалась тенденція до зростання акумуляції катіону за цих умов. Одержані результати вказують на несуттєву роль CspA-чутливої пори перехідної проникності в біохімічних механізмах стимуляції транспорту Са2+ в МХ під впливом нітросполук. Таким чином, можна припустити фізіологічне значення NO в стимуляції енергозалежного транспорту Са2+ в МХ, що є важливим для зниження концентрації Са2+ в міоплазмі.
Отже, нами було продемонстровано, що Са2+-чутливий флюоресцентний зонд Fluo-4 AM можна успішно використовувати для вивчення закономірностей трансмембранного обміну іонів Са в ізольованих МХ гладенького м'язу. Також проілюстровано, що існує феномен накопичення Са2+ деенергізованими МХ міометрія. Було показано присутність NO в МХ інтактних міоцитів матки. Доведено, що під впливом нітросполук спостерігається посилення енергозалежної акумуляції Са2+ в ізольованих МХ міометрія. Стимулювальний ефект опосередковується активацією Са2+-уніпортера і не залежить від функціонування пори перехідної проникності.
2. Система Са2+/Н+-обміну мітохондрій міометрія та вплив нітросполук і вибраних калікс[4]аренів на її активність
Було досліджено процес вивільнення Са2+ із МХ, попередньо акумульованого в енергозалежному процесі протягом 5 хв (за присутності Mg-АТР2- та сукцинату), який залежав від величини позамітохондріального рН (рН 8,0-5,0), рис. 6. При закисленні середовища суттєво посилюється вихід Са2+ з МХ, що свідчить на користь існування ∆рН-залежного компоненту транспорту Са2+ з МХ і відповідає уявленням про існування Са2+/Н+-обміну у внутрішній мітохондріальній мембрані гладеньких м’язів. При залужненні позамітохондріального середовища спостерігається додаткове зростання акумуляції катіону, що свідчить на користь можливості функціонування Са2+/Н+-обміну в реверсному режимі (рис. 6).
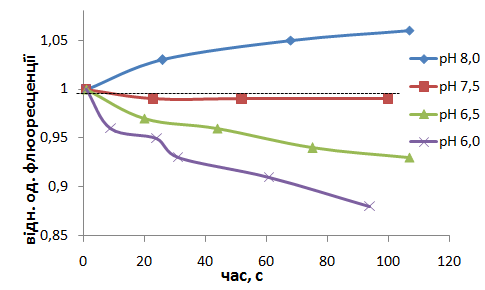
Рис. 6. Транспорт Са2+ в мітохондріях за умови зміни рН стандартного середовища інкубації. Ефективність процесу залежить від величини ∆рН. Метод спектрофлюориметрії, флюоресцентний зонд Fluo-4 АМ. Результат типового експерименту
Проведені розрахунки показали, що за умови зростання градієнту протонів, як рушійної сили виходу Са2+ з МХ (при закисленні середовища від рН 7,5 до рН 5,0), час напіввивільнення катіону (t1/2) зменшується майже у 5 разів. Отже, швидкість Са2+/Н+-обміну зростає в умовах збільшення ∆рН на мембрані МХ.
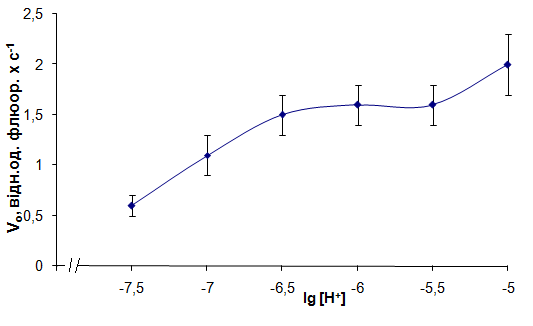
Рис. 7. Залежність початкової швидкості вивільнення іонів Са з мітохондрій від концентрації протонів. Метод спектрофлюориметрії, флюоресцентний зонд Fluo-4 АМ. (М±m, n=6-8)
Згідно сучасних уявлень [Schlickum S.etal., 2004; Dimmer K.S.etal., 2008; Nowikovsky K.etal., 2012], молекулярною структурою, яка забезпечує функціонування Са2+/Н+-обмінника у внутрішній мембрані МХ, виступає протеїн Letm1 (leucine-zipper-EFhand-containingtransmembraneregion). Нами було встановлено, що комерційні моноклональні антитіла проти Letm1 (Anti-Letm1) суттєво пригнічували процес ∆рН-індукованого вивільнення Са2+ з мітохондріального матриксу; ефект залежав від часу інкубації МХ з антитілами. Отже, є підстави припустити, що МХ міометрія щурів володіють транспортною системою Са2+/Н+-обмінника, яка представлена протеїном Letm1.
Крива залежності швидкості вивільнення іонів Са з ізольованих МХ міометрія від концентрації протонів в середовищі їхнього розведення має тенденцію до насичення (рис. 7), а розрахована нами константа активації за протонами (-lgKа або рКа) cкладає 6,9±0,1 (n=6), що свідчить про можливість функціонування системи Na+-незалежного виходу Са2+ з МХ за близького до фізіологічного значення рН. Величина коефіцієнту Хілла (nH) становить 0,90±0,05 (n=6), що вказує на стехіометрію Са2+/Н+-обміну 1:1 і, відповідно, електрогенність транспортувальної системи (1 Са2+ обмінюється на 1H+).
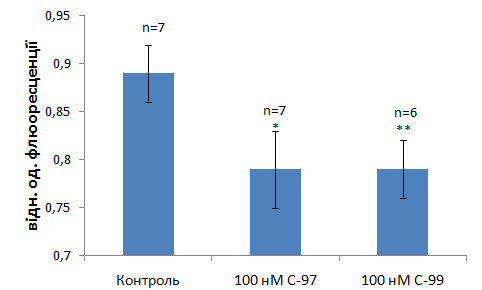
Рис. 8. Вибрані калікс[4]арени (С-97 та С-99) стимулюють ∆рН-індукований транспорт Са2+ в мітохондріях.Метод спектрофлюориметрії, флюоресцентний зонд Fluo-4 АМ. M±m; */- зміни достовірні відносно контролю Р<0,1; **/- Р<0,05.Cтандартне середовище інкубації (рН 6,5)
Подальші експерименти було спрямовано на пошук ендо- та екзогенних модифікаторів Са2+/Н+-обміну. Нас зацікавили калікс[4]арени С-97 та С-99 як такі, що здатні модулювати з високою ефективністю широкий спектр АТР-гідролазних реакцій, в тому числі і тих, що пов’язані із трансмембранним транспортуванням катіонів [Лабинцева Р.Д. та ін., 2007; Бевза О.В. та ін., 2013; Veklichetal., 2014]. Нами встановлено, що вибрані калікс[4]арени – інгібітори натрієвої помпи плазматичної мембрани, високоафінно стимулюють Са2+/Н+-обмін (рис. 8).
Відомо, що транспортування Са2+ у внутрішній мембрані МХ модулюється іонами Mg та діуретиками (амілорид) [GunterT.E.etal, 1990]. В наших дослідженнях 4,5 мМ Mg2+ пригнічував, а 100 мкМ амілорид - стимулював Са2+/Н+-обмін.
Водночас, Са2+/Н+-обмін виявився нечутливим до дії нітросполук. Отже, стимуляція NOенергозалежної акумуляції іонів Са органелами на фоні відсутності ефекту на вихід катіону може забезпечити ефективне зниження концентрації Са2+ в міоплазмі поблизу МХ.
Таким чином, нами ідентифіковано Са2+/Н+-обмінник в МХ міометрія щурів. Молекулярною основою функціонування транспортувальної системи є протеїн Letm1. Антипортер працює за фізіологічних значень рН зі стехіометрію 1:1, що вказує на його електрогенність. Обмінник є нечутливим до дії нітросполук, але стимулюється калікс[4]аренами С-97, С-99 та амілоридом і пригнічується іонами Mg.
3. Вплив нітросполук та вибраних калікс[4]аренів на поляризацію внутрішньої мембрани мітохондрій міометрія.
З метою дослідження впливу нітросполук на ступінь поляризації внутрішньої мембрани МХ в міоцитах ми використали метод лазерної конфокальної скануючої мікроскопії та потенціалчутливий зонд карбоціанінового ряду DiOC6(3). Встановлено, що розподіл специфічного щодо МХ флюоресцентного барвника MitoTrackerOrange та DiOC6(3) в міоплазмі має подібний характер (рис. 9). Це дає підставу вважати, що накопичення DiOC6(3) в клітині передусім пов’язане із МХ.
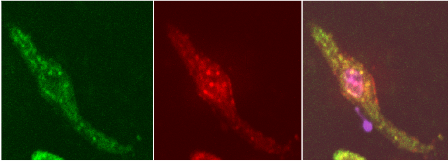
Рис. 9. Розподіл флюоресцентних зондів в міоциті матки: а - зелений – DiOC6(3), б - червоний – MitoTrackerOrangeCM-H2TMRos, в – накладання обох зображень; фіолетовий – Hoechst 33342. Метод лазерної конфокальної мікроскопії
Подальшими експериментами виявлено, що 0,1 мМ SNP призводив до зниження флюоресценції DіОС6(3) в середньому на 17 %. В порівняльних дослідженнях SN у аналогічній концентрації не чинив будь-якого ефекту на флюоресценцію. Одержаний результат був якісно підтверджений нами із використанням методу протокової цитофлюориметрії.
Помірне зниження потенціалу внутрішньої мембрани МХ за дії SNP можна пояснити стимуляцією NO транспорту позитивно заряджених іонів Са у матрикс, а також пригніченням роботи окремих комплексів електрон-транспортувального ланцюга внаслідок гальмівної дії NO на них. Відомо, що збільшення Δφ на внутрішній МХ мембрані призводить до генерації супероксид-аніону убісеміхіноном та комплексом I. Отже, ми розглядаємо зареєстроване нами зменшення мітохондріального потенціалу за дії нітросполук як прояв протекторної дії оксиду азоту, який спроможний захищати МХ від надлишкової продукції супероксид-аніону, а також Са2+-перевантаження [Костюк П.Г. та ін., 2010].
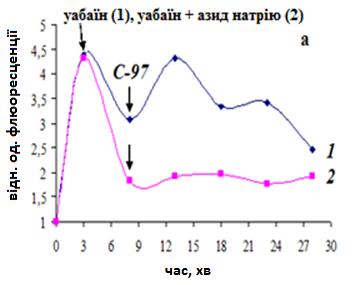
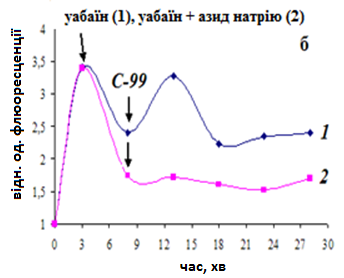
Рис. 10. Дія калікс[4]аренів С-97 (а) та С-99 (б) на поляризацію внутрішньої мітохондріальної мембрани. Стрілочкою вказано момент додавання (на 3 хв інкубації клітин з зондом) 1мМ уабаїну (1) або 1мМ уабаїну+5мМ азиду натрію (2) та (на 8 хв) калікс[4]аренів (100 нМ). Метод протокової цитофлюориметрії, флюоресцентний зонд DiOC6(3).Стандартне середовище інкубації. Результати характерного досліду
Оскільки Са2+/Н+-обмін в МХ міометрія може здійснюватись в електрогенному режимі, його стимуляція калікс[4]аренами повинна призвести до зростання мітохондріального потенціалу. Згідно результатів протокової цитофлюориметрії, калікс[4]арени С-97 та С-99 викликали транзієнтну поляризацію мітохондріальної мембрани, тривалість якої становила біля 5 хв. За умов одночасної деполяризації плазматичної і мітохондріальної мембрани, спричиненою попередньою інкубацією клітин з 1 мМ уабаїном та 5 мМ азидом натрію, внесення зазначених калікс[4]аренів не викликало змін в інтенсивності флюоресценції зонду (рис. 10). Одержані результати підтверджено методом лазерної конфокальної мікроскопії.
Таким чином,NO викликає помірне зменшення трансмембранного мітохондріального потенціалу в клітинах міометрія. Калікс[4]арени С-97 та С-99 здатні викликати транзієнтну поляризацію мітохондріальної мембрани, що узгоджується із фактом активації ними Са2+/Н+ -обмінника.
ВИСНОВКИ
У дисертаційній роботі в дослідах, виконаних на ізольованих мітохондріях та міоцитах матки щурів, було вивчено трансмембранний обмін Са2+ в мітохондріях міометрія та поляризацію їхньої мембрани за дії оксиду азоту та калікс[4]аренів із застосуванням методів спектрофлюориметрії, протокової цитофлюориметрії та лазерної конфокальної мікроскопії.
За результатами роботи зроблено наступні висновки:
1. Са2+-чутливий флюоресцентний зонд Fluo 4-AMдоцільно використовувати для вивчення закономірностей обміну Са2+ в ізольованих мітохондріях міометрія.
2. Вперше доведено наявність NO в мітохондріях міоцитів матки. Оксид азоту посилює енергозалежну акумуляцію іонів Са мітохондріями міометрія. Стимулювальний ефект опосередкований активацією Са2+-уніпортера та не залежить від функціонування пори перехідної провідності.
3. При дослідженні властивостей Са2+/Н+-обміну у внутрішній мембрані мітохондрій міометрія було встановлено, що антипортер активується за фізіологічних значень рН та функціонує із стехіометрією 1:1.
4. Са2+/Н+-обмін в мітохондріях міометрія є нечутливим до дії оксиду азоту, але стимулюється калікс[4]аренами С-97, С-99 та амілоридом і пригнічується іонами Mg.
5. Із використанням специфічних щодо мітохондрій флюоресцентних зондів встановлено, що потенціалчутливий барвник ціанінового ряду DIOC6(3) зв'язується з енергізованими мітохондріями міометрія і його можна використовувати для тестування змін мітохондріального потенціалу.
6. Доведено, що оксид азоту спричиняє зниження потенціалу на внутрішній мембрані мітохондрій.
7. Калікс[4]арени С-97 та С-99 викликають виражену транзієнтну поляризацію внутрішньої мембрани мітохондрій, що узгоджується з їхнім стимулюючим впливом на Са2+/Н+-обмінник.
СПИСОК ОПУБЛІКОВАНИХ РОБІТ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Данилович Г.В. Зміни поляризації плазматичної та внутрішньої мітохондріальої мембран клітин міометрія за дії каліксаренів – інгібіторів Na+, K+-АТР-ази плазматичної мембрани / Г.В. Данилович, Ю.В. Данилович, О.В. Коломієць, С.О. Костерін, Р.В. Родік, С. О. Черенок, В.І. Кальченко, О.Ю. Чуніхін, В. Ф. Горчєв, С. О. Карахім // Укр. біохім. журн. –2012. - Т.84, № 6. - С. 37-48. (Особистий внесок здобувача – виділення гладеньком'язових клітин матки щурів, участь у проведенні експериментів, участь у обговоренні результатів експериментів та написанні рукопису статті).
2. Коломієць О.В. Вивчення акумуляції Са2+ в ізольованих мітохондріях гладенького м'яза за допомогою зонда Fluo-4 AM / О.В. Коломієць, Г.В. Данилович, Ю.В. Данилович, С.О. Костерін // Укр. біохім. журн. –2013. - Т.85, № 4. - С. 30-39. (Особистий внесок здобувача – виділення ізольованих мітохондрій міометрія щурів, проведення експериментів, кінетичний аналіз та статистична обробка даних, участь у обговоренні результатів експериментів та написанні рукопису статті).
3. Данилович Ю.В. Дослідження впливу нітрозактивних сполук на поляризацію внутрішньої мембрани мітохондрій в міоцитах матки щурів із використанням потенціалчутливого флюоресцентного зонда DіОС6(3) / Ю.В. Данилович, Г.В. Данилович, О.В. Коломієць, С.О. Костерін, С.О. Карахім О.Ю. Чуніхін // Укр. біохім. журн. –2014. - Т.86, № 1. - С. 42-55. (Особистий внесок здобувача – виділення гладеньком'язових клітин матки щурів, участь у проведенні експериментів, участь у обговоренні результатів експериментів та написанні рукопису статті)
4. Коломієць О.В. Са2+/Н+-обмін у мітохондріях міометрія / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович, С.О. Костерін // Укр. біохім. журн. –2014. - Т.86, № 3. - С. 41-48. (Особистий внесок здобувача – виділення ізольованих мітохондрій міометрія щурів, проведення експериментів, кінетичний аналіз та статистична обробка даних, участь у обговоренні результатів експериментів та написанні рукопису статті).
5. Данилович Ю.В. Оксид азоту як один із регуляторів енергозалежного транспорту Са2+ в мітохондріях міометрія / Ю.В. Данилович, О.В. Коломієць, Г.В. Данилович, С.О. Костерін // Фізіол. журн. –2014. - Т.60, № 2. - С. 12-17. (Особистий внесок здобувача – виділення ізольованих мітохондрій міометрія щурів, проведення експериментів, статистична обробка даних, участь у обговоренні результатів експериментів та написанні рукопису статті).
6.Коломієць О.В. Н+–Са2+-обмінник у мітохондріях міометрія: модуляція екзо- та ендогенними сполуками / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Фізіол. журн. –2014. - Т.60, № 5. – С. 33-42. (Особистий внесок здобувача – виділення ізольованих мітохондрій міометрія щурів, проведення експериментів, статистична обробка даних, участь у обговоренні результатів експериментів та написанні рукопису статті).
7. Данилович А.В. Влияние каликс[4]аренов - ингибиторов Na+, K+-АТР-азы на поляризацию плазматической и митохондриальной мембран гладкомышечных клеток матки / А.В. Данилович, Ю.В. Данилович, О.В. Коломиец // Тези доповідей VIII Міжнародної науково-технічної конференції «Актуальні питання біологічної фізики та хімії». Севастополь. Україна. – 2012. – С. 168-169.
8. Коломієць О.В. Окремі закономірності акумуляції іонів Са в ізольованих мітохондріях міометрія, досліджені із використанням Са2+-чутливого флюоресцентного зонду Fluo-4 АМ / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Тези доповідей ІХ Міжнародної науково-технічної конференції «Актуальні питання біологічної фізики та хімії». Севастополь. Україна. – 2013. – С. 147-148.
9. Данилович Ю.В. Использование метода лазерной конфокальной микроскопии и потенциалчувствительного флюоресцентного зонда DiОC6(3) для исследования влияния нитрозактивных соединений на поляризацию внутренней митохондриальной мембраны гладкомышечных клеток / Ю.В. Данилович, А.В. Данилович, О.В. Коломиец, А.Ю. Чунихин, Карахим С.А. // Тези доповідей Міжнародної міждисциплінарної наукової конференції «Біологічно активні речовини та матеріали: фундаментальні і прикладні питання отримання і використання». Новий Світ. Україна. – 2013. – С. 103.
10. Коломієць О.В. Дослідження властивостей транспортування Са2+ в мітохондріях міометрія з використанням флюоресцентного зонда Fluo-4 АМ / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Тези доповідей Наукової конференції молодих вчених «Актуальні проблеми біохімії та біотехнології». Київ. Україна. – Укр. біохім. журн. –2013. - Т.85, № 4. - С. 139.
11. Коломієць О.В. Вплив оксиду азоту на трансмембранний обмін Са2+ та поляризацію внутрішньої мембрани мітохондрій гладенького м'язу / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Тези доповідей III Всеукраїнської наукової конференції молодих вчених «Фізіологія: від молекул до організму» . Київ. Україна. – 2013. – С. 15-16.
12. Коломієць О.В. Електрогенний Са2+/Н+-обмін у мітохондріях міоцитів матки та його модуляція калікс[4]аренами / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Тези доповідей Наукової конференції молодих вчених «Актуальні проблеми біохімії та біотехнології». Київ. Україна. – Укр. біохім. журн. –2014. - Т.86, № 4. - С. 202.
13. Данилович Ю.В. Оксид азоту – потенційний регулятор Са2+-гомеостазу гладенького м’яза матки та рівня поляризації його субклітинних структур / Ю.В. Данилович, Г.В. Данилович, О.В. Коломієць // Тези доповідей ХІ Українського біохімічного конгресу. Київ. Україна. – Ukr. Biochem. J. –2014. - Vol.86, N 5. - С. 100-101.
14. Коломієць О.В. Оксид азоту як можливий регулятор функціональної активності мітохондрій / О.В. Коломієць, Ю.В. Данилович, Г.В. Данилович // Тези доповідей ХІ Українського біохімічного конгресу. Київ. Україна. – Ukr. Biochem. J. –2014. - Vol.86, N 5. - С. 163-164.
АНОТАЦІЯ
Коломієць О. В. Трансмембранний обмін Са2+ в мітохондріях міометрія за дії оксиду азоту та калікс[4]аренів. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.04. – біохімія. Інститут біохімії ім. О.В.Палладіна НАН України, Київ, 2015.
Із використанням методів спектрофлюориметрії, протокової цитофлюориметрії та лазерної конфокальної мікроскопії за допомогою Са2+-чутливого флюоресцентного зонду Fluo 4-AMта потенціалчутливого зонду DIOC6(3) в дослідах, виконаних на ізольованих мітохондріях та міоцитах матки щурів, було досліджено властивості систем трансмембранного обміну Са2+, а саме Са2+-уніпортеру та Са2+/Н+-обмінника внутрішньої мембрани мітохондрій, модулюючу дію на них нітросполук та вибраних калікс[4]аренів, а також вплив цих речовин на поляризацію внутрішньої мембрани мітохондрій.
Доведено, що Са2+-чутливий флюоресцентний зонд Fluo 4-AM можна використовувати для вивчення закономірностей обміну Са2+ в мітохондріях міометрія. Показано, що оксид азоту утворюється і посилює енергозалежну акумуляцію іонів Са в мітохондріях міометрія. Стимулюючий ефект опосередкований активацією Са2+-уніпортера та не залежить від функціонування пори перехідної провідності. Досліджено властивості Са2+/Н+-обміну у внутрішній мембрані мітохондрій міометрія, зокрема, встановлено, що він здійснюється з стехіометрією 1:1 та функціонує за фізіологічних значень рН. Виявлено, що Са2+/Н+-обмін є нечутливим до дії оксиду азоту, але стимулюється калікс[4]аренами С-97, С-99 та амілоридом і пригнічується іонами Mg. Встановлено, що потенціалчутливий барвник ціанінового ряду DіOC6(3) зв'язується з енергізованими мітохондріями і його можна використовувати для тестування змін мітохондріального потенціалу. Доведено, що оксид азоту спричиняє зниження потенціалу на внутрішній мембрані мітохондрій. Показано, що калікс[4]арени С-97 та С-99 викликають виражену транзієнтну поляризацію внутрішньої мембрани мітохондрій, що узгоджується з їхнім стимулювальним впливом на Са2+/Н+-обмін.
Одержані результати мають значення для розуміння ролі мітохондрій у контролі Са2+-гомеостазу в гладеньком'язових клітинах матки та їхнього функціонування у забезпеченні спряження між збудженням та скороченням в міометрії.
Ключові слова: Са2+, мітохондрії, клітини гладенького м’язу, оксид азоту, калікс[4]арени, міометрій.
АННОТАЦИЯ
Коломиец О. В. Трансмембранный обмен Са2+ в митохондриях миометрия при действии оксида азотаи каликс[4]аренов. – Рукопись.
Диссертация на соискание научной степени кандидата биологических наук по специальности 03.00.04. – биохимия. Институт биохимииим. О.В.Палладина НАН Украины, Киев, 2015.
Используя методы спектрофлуориметрии, проточной цитофлуориметрии и лазерной конфокальной микроскопии с помощьюСа2+-чуствительного флуоресцентного зонда Fluo 4-AM,NO-чувствительного зондаDAFи потенциалчувствительного зонда DiOC6(3) в опытах, выполненных на изолированных митохондриях и миоцитах матки крыс, было показано образование оксида азота в митохондриях миоцитов матки, исследованысвойства систем трансмембранного обмена Са2+, а именно Са2+-унипортераи Са2+/Н+-обменника внутренней мембраны митохондрий, модулирующее действие на них нитросоединенийиизбранных каликс[4]аренов, а такжевлияниеэтихвеществ на поляризацию внутренней мембраны митохондрий.
Доказано, что Са2+-чувствительныйфлуоресцентный зонд Fluo 4-AM можноиспользовать для изучения закономерностей обмена Са2+ в митохондриях миометрия. С помощьюNO-чувствительногофлуоресцентного зондаDAFоксид азотавпервые идентифицированв митохондриях миоцитов матки.Показано, что оксид азота усиливаетэнергозависимую аккумуляциюионов Са в митохондриях миометрия. Стимулирующее действие опосредовано активацией Са2+-унипортера и не зависитот функционивания циклоспоринчувствительной митохондриальной поры. Эти эффекты могут иметь функциональное значение в стимуляцииNOэнергозависимого транспорта Са2+ митохондриями, что важно для снижения концентрации Са2+ в миоплазме.
Идентифицирован Са2+/Н+-обменник в митохондриях миометрия крыс.С помощью моноклональных антител установлено, что данная транспортная система репрезентирована протеином Letm1.Исследованысвойства Са2+/Н+-обмена во внутренней мембране митохондрий миометрия, в том числеустановлено, что оносуществляетсяв стехиометрии 1:1, что указывает на его электрогенность,и функционируетпри физиологических значениях рН. Показано, что Са2+/Н+-обмен резистентныйк действию оксида азота, но стимулируется каликс[4]аренами С-97, С-99 и амилоридом, а также угнетаетсяионами Mg. С использованием специфических к митохондриям флуоресцентных зондов установлено, что потенциалчуствительныйкраситель цианинового рядаDіOC6(3) связываетсяс энергизированными митохондриями и его можноиспользовать для тестированияизменений митохондриального потенциала. Доказано, что оксид азотаспособствуетумеренному снижению потенциала на внутренней мембране митохондрий, что может быть проявлением его протекторного действия. Показано, что каликс[4]арены С-97 и С-99 вызывают выраженную транзиентную поляризацию внутренней мембраны митохондрий, что согласовывается с их стимулирующимвлиянием на Са2+/Н+-обмен.
Полученные результатыимеют значение для понимания ролимитохондрий в контроле Са2+-гомеостазагладкомышечныхклетокматки и их значения вобеспечениисопряжения между возбуждениеми сокращением в миометрии.
Ключевые слова: Са2+, митохондрии, клеткигладкой мышцы, оксид азота, каликс[4]арены, миометрий.
SUMMARY
Kolomiets O.V.TransmembraneCa2+ exchangeinmyometrialmitochondriainconditionsofnitricoxideandcalix[4]areneinfluence. – Manuscript.
Dissertation thesis on obtaining the scientific degree of PhD (Biology) in the speciality 03.00.04. – biochemistry. Palladin Institute of Biochemistry of NAS of Ukraine, Kyiv, 2015.
By spectroscopy, flow cytometry and laser confocal microscopy study with Ca2+-sensitive dye Fluo-4 AM and potential-sensitive dye DIOC6(3) in experiments, performed on isolated mitochondria and myocytes of rat uterus, was investigated properties of Ca2+ transmembrane exchange systems, namely Ca2+ uniporter and Ca2+/H+-exchanger of inner mitochondrial membrane, by influencing nitrocompoundsand calix[4]arenes, and also impact of those compounds on inner mitochondrial membrane polarization.
It is confirmed, that Ca2+-sensitive fluorescent dye Fluo-4 AM can be used for investigation Ca2+ exchange regularities in myometrium mitochondria. It is shown that nitric oxide increase energy-dependent accumulation of Ca ions in myometrial mitochondria. This effect is mediated by Ca2+-uniporter activation and do not dependent on PTP functioning.It is investigated Ca2+/H+-exchange properties in inner membrane of myometrium mitochondria, namely this exchange has stoichiometry 1:1 and functioning in different pH. It is found that Ca2+/H+ exchange resistant to nitric oxide influence, but stimulated by calix[4]arene C-97, C-99 and amilorideand inhibited by Mg ions. It is established that potential-sensitive dye of cyanide group DіOC6(3) binds with energizedmithochondia and can be used for testing mitochondrial potential changes. It is confirmed that nitric oxide cause mitochondrial inner membrane potential decrease. It is shown that calix[4]arene C-97 and C-99 provoke transient mitochondrial inner membrane polarization, which cohere with its stimulating influence on Ca2+/H+-exchange.
The obtained results are important for understanding the role of mitochondria in control of Ca2 + homeostasis in uterus smooth muscle cells and their functioning in ensuring the coupling between excitation and contraction in the myometrium.
Key words: Ca2+, mitochondria, smooth muscle cells, nitric oxide, calix[4]arenes, myometrium.
ВІДГУК
на дисертаційну роботу КОЛОМІЄЦЬ ОКСАНИ ВАЛЕРІЇВНИ «ТРАНСМЕМБРАННИЙ ОБМІН Са2+ В МІТОХОНДРІЯХ МІОМЕТРІЯ ЗА ДІЇ ОКСИДУ АЗОТУ ТА КАЛІКС[4]АРЕНІВ», представлену на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.04 – біохімія. (ВІДГУК1- pdf,ВІДГУК2- pdf )