Порядок денний: захист дисертації на здобуття наукового ступеня
кандидата біологічних наук
Рока-Мойя Яною Маріовною
на тему: «РЕГУЛЯЦІЯ АГРЕГАЦІЇ ТРОМБОЦИТІВ
ПЛАЗМІНОГЕН/ПЛАЗМІНОВОЮ СИСТЕМОЮ»
Науковий керівник – доктор біологічних наук, старший науковий співробітник, завідувач відділу хімії та біохімії ферментів Інституту біохімії ім. О.В. Палладіна НАН України
Гриненко Тетяна Вікторівна
Офіційні опоненти:
член-кореспондент НАН України,доктор біологічних наук, професор, завідувач відділу ензимології білкового синтезу,заступник директора з наукової роботиІнституту молекулярної біології і генетики НАН України
Тукало Михайло Арсентійович
старший науковий співробітник,завідувач лабораторії біохіміїДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України»
Верьовка Сергій Вікторович
НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
ІНСТИТУТ БІОХІМІЇ ІМ. О.В. ПАЛЛАДІНА
РОКА-МОЙЯ ЯНА МАРІОВНА
УДК 616.155.2+576.522+616.155.2
РЕГУЛЯЦІЯ АГРЕГАЦІЇ ТРОМБОЦИТІВ
ПЛАЗМІНОГЕН/ПЛАЗМІНОВОЮ СИСТЕМОЮ
03.00.04 – біохімія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Київ – 2015
Дисертацією є рукопис.
Робота виконанав Інституті біохімії ім. О.В. Палладіна НАН України.
| Науковий керівник: |
доктор біологічних наук, старший науковий співробітник Гриненко Тетяна Вікторівна, Інститут біохімії ім. О.В. Палладіна НАН України, завідувач відділу хімії та біохімії ферментів. |
| Офіційні опоненти: |
член-кореспондент НАН України, доктор біологічних наук, професор Тукало Михайло Арсентійович, Інститут молекулярної біології і генетики НАН України, завідувач відділу ензимології білкового синтезу, заступник директора з наукової роботи. |
|
доктор біологічних наук, старший науковий співробітник Верьовка Сергій Вікторович, ДУ «Інститут отоларингології завідувач лабораторії біохімії. |
Захист відбудеться “26” жовтня 2015 р. о 14 годині на засіданні спеціалізованої вченої ради Д 26.240.01 в Інституті біохімії ім. О.В. Палладіна НАН України за адресою: 01601, м. Київ, вул. Леонтовича, 9.
З дисертацією можна ознайомитись у бібліотеці Інституту біохімії ім. О.В. Палладіна НАН України (01601, м. Київ, вул. Леонтовича, 9).
Автореферат розісланий “_____” вересня 2015 р.
Вчений секретар
спеціалізованої вченої ради,
кандидат біологічних наук Н.П. Карлова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Сьогодні серцево-судинні захворювання тромботичного ґенезу впевнено утримують лідуючі позиції у світовому рейтингу смертності населення, тому дослідження клітинних та молекулярних механізмів тромбоутворення є актуальною медико-біологічною проблемою. Тромбоцити – це невеликі без’ядерні клітини крові, основною функцією яких є зупинка кровотечі та відновлення цілісності кровоносних судин після пошкодження. Здатність тромбоцитів синтезувати, селективно накопичувати та вивільняти цілу низку регуляторних молекул обумовлює їх участь у регенеративних процесах, імунних реакціях, запаленні та тромбоґенезі. Надмірна активація тромбоцитів може бути однією з причин тромботичних ускладнень за ряду серцево-судинних, метаболічних, онкологічних захворювань, а також у післяопераційний період на фоні терапії фібринолітичними та антикоагулянтними препаратами системної дії. Тому ідентифікація чинників, що впливають на тромбоцитарну ланку гемостазу, а також розкриття біохімічних процесів, що лежать в основі дії біологічно активних речовин на тромбоцити, мають велике науково-практичне значення.
Плазміноген/плазмінова система забезпечує розчинення тромбів в судинному руслі за рахунок розщеплення сітки полімерного фібрину у їх складі, а також бере участь в регуляції функціонування різних клітин крові [Syrovets,2004; Жерносєков, 2012]. Плазміноген є неактивним попередником серинової протеїнази плазміну (КФ 3.4.21.7), ключового ензиму плазміноген/плазмінової системи. В плазмі крові зимоген циркулює у формі Glu-плазміногену. Молекула Glu-плазміногену має закриту конформацію та складається з 7 структурних доменів: N-кінцевого фінгер-домену, 5 кринглових доменів та С-кінцевого серинпротеїназного домену. У кринглових доменах локалізовані лізинзв'язувальні сайти (LBS) – специфічні ділянки міжмолекулярного розпізнавання, що опосередковують взаємодію плазмін(оген)у з субстратами, активаторами, інгібіторами та рецепторами на клітинній поверхні [Nieuwenhuizen,2001; Гриненко,2007; Law,2013]. Плазматична мембрана клітин крові може виступати місцем асоціації протеїнів плазміноген/плазмінової системи та активації плазміногену. На поверхні ендотеліоцитів та моноцитів Glu-плазміноген шляхом обмеженого протеолізу перетворюється на Lys-форму, що має відкриту конформацію і з більш високою швидкістю активується до плазміну [Gong,2001]. В молекулі Lys-плазміногену LBS кринглових доменів є доступними для міжмолекулярних взаємодій, тому така форма зимогену може розглядатися як мультивалентний адгезивний ліганд.
Потужний арсенал секреторних протеїнів тромбоцитів включає основні інгібітори плазміноген/плазмінової системи – α2-антиплазмін, інгібітор активатора плазміногену 1 типу (РАІ-1), а також ряд протеїнів (фібриноген, вітронектин, тромбоспондин), які можуть зв’язувати плазміноген та є необхідними для процесів активації та агрегації тромбоцитів [Maron&Loscalzo,2007]. Відомо, що тромбоцити на плазматичній мембрані містять сайти зв’язування плазміногену, кількість яких значно зростає при стимуляції клітин агоністами агрегації [Miles, 1985]. Дані літератури щодо впливу тромбоцитів на активність плазміноген/плазмінової системи є обмеженими, тоді як відомості стосовно ролі плазміногену та його фрагментів у регуляції функціонального стану тромбоцитів на сьогодні відсутні. Вивчення реципрокних взаємодій між плазміноген/плазміновою системою та тромбоцитарною ланкою гемостазу є необхідним для розуміння біохімічних механізмів регуляції процесів тромбоутворення й тромболізису.
Зв’язок роботи з науковими програмами, планами, темами. Представлена дисертаційна робота є завершеним дослідженням, що виконане автором відповідно до програми експериментальних досліджень, спланованих, проведених та узагальнених протягом 2008-2014 років. Робота виконана згідно з планом науково-дослідних робіт відділу хімії та біохімії ферментів Інституту біохімії ім. О.В. Палладіна НАН України в рамках науково-дослідних тем «Структурно-функціональний аналіз білків за норми та деяких патологій» (№ ДР 0107V007187, 2007-2011рр.), «Молекулярні механізми функціонування ферментів системи гемостазу» (№ ДР 0110U002701, 2010-2012 рр.), «Розробка діагностикумів для тестування стану системи руйнування тромбів» (№ ДР 0113U003649, 2013-2015 рр.), «Ангіостатини як ендогенні регулятори функціональної активності клітин» (№ ДР 0112U002624, 2012-2016 рр.), «Механізми регуляції плазміноген/плазміном міжклітинних та міжмолекулярних взаємодій в системі гемостазу за норми та патології» (№ ДР 0113U003203, 2013-2017 рр.).
Мета і завдання дослідження. Метою дослідження було з’ясувати роль компонентів плазміноген/плазмінової системи в регуляції агрегації тромбоцитів та встановити закономірності активації плазміногену за участі тромбоцитів.
Для досягнення поставленої мети необхідно було вирішити такі завдання:
- Визначити кінетичні параметри активації плазміногену тканинним активатором плазміногену за присутності інтактних та активованих тромбоцитів.
- Розробити метод та визначити активність інгібітора активатора плазміногену
1 типу в тромбоцитах та плазмі крові. - Вивчити вплив Glu- та Lys-форм плазміногену на агрегацію тромбоцитів та перебудову їх актинового цитоскелету за стимуляції різними агоністами.
- Оцінити внесок окремих кринглових доменів та серинпротеїназного домену молекули плазміногену у його здатність впливати на агрегацію тромбоцитів.
- Дослідити вплив антикоагулянтних препаратів гепарину на агрегацію тромбоцитів та ефект плазміногену щодо агрегації.
Об’єкти дослідження: плазміноген/плазмінова система та тромбоцити людини.
Предмет дослідження: вплив плазміногену та його фрагментів на функціональний стан тромбоцитів, процес активації плазміногену тканинним активатором плазміногену за участі тромбоцитів.
Методи дослідження:методи препаративної біохімії, хроматографічні методи – афінна, іонообмінна та гель-проникна хроматографія, диференційне центрифугування, визначення активності ензимів, оптична агрегометрія, спектрометрія, турбідиметрія, гель-електрофорез та імуноблотинг з наступною денситометрією, методи статистичного аналізу.
Наукова новизна отриманих результатів. Вперше встановлено, що Lys-плазміноген, на відміну від Glu-плазміногену та окремих кринглвмісних фрагментів плазміногену, селективно пригнічує агрегацію тромбоцитів людини, індуковану АDP, тромбіном і колагеном та не впливає на ристоміцин-залежну аглютинацію тромбоцитів. Показано, що Glu-плазміноген специфічно зв’язується з поверхнею активованих тромбоцитів і може перетворюватися на Lys-плазміноген. Вперше встановлено, що Lys-плазміноген перешкоджає агоніст-індукованій реорганізації актинового цитоскелету тромбоцитів, що розглядається як один із механізмів його антиагрегаційної дії. Показано, що аналог лізину 6-аміногексанова кислота та кринглвмісні фрагменти плазміногену (К1-3, К4 та К5) перешкоджають інгібуванню Lys-плазміногеном агрегації тромбоцитів, тоді як інгібітор серинових протеїназ апротинін не виявляє подібного ефекту. Плазмін в наномолярній концентрації не впливає на тромбін-індуковану агрегацію тромбоцитів. Висловлено припущення, що антиагрегаційний ефект Lys-плазміногену обумовлений його взаємодією з мембраноасоційованими протеїнами тромбоцитів, що експонуються під час активації та беруть участь в процесі агрегації. Така взаємодія опосередкована лізинзв’язувальними сайтами кринглових доменів зимогену. Отже, вперше встановлено, що плазміноген/плазмінова система обмежує агрегаційну здатність тромбоцитів і в такий спосіб залучається до регуляції функціонального стану цих клітин.
Отримало подальшого розвитку питання участі тромбоцитів у регуляції активності плазміноген/плазмінової системи. Встановлено, що тромбоцити підвищують ефективність каталізу реакції активації плазміногену тканинним активатором плазміногену (tPA). Показано, що інтактні тромбоцити є депо активної форми РАІ-1, який вивільняється в плазму крові в ході агоніст-індукованої агрегації тромбоцитів і здатний ефективно пригнічувати процес активації плазміногену tPA та утворення плазміну.
Досліджено вплив антикоагулянтних препаратів на основі гепарину на тромбоцити. Встановлено, що за терапевтичних концентрацій в плазмі крові препарати гепарину не індукують спонтанну агрегацію та не впливають на агрегацію тромбоцитів, стимульовану ADP. Разом з тим нефракціонований гепарин може індукувати помірну активацію тромбоцитів з наступним вивільненням тромбоцитами РАІ-1 в плазму крові.
Практичне значення отриманих результатів. Результати стосовно підвищення тромбоцитами ефективності активації плазміногену тканинним активатором та інгібування агоніст-індукованої агрегації тромбоцитів Lys-плазміногеном можуть стати основою для розробки нових терапевтичних підходів контролю тромбоутворення та тромболізису.
Розроблено та валідовано кількісний метод визначення активності РАІ-1 в тромбоцитах та плазмі крові людини із використанням desAB-фібрину бика як стимулятора. Метод може знайти застосування в лабораторно-клінічній практиці для оцінки рівня функціонально активного РАІ-1 в плазмі крові хворих на серцево-судинні захворювання при діагностиці та прогнозуванні тромботичних ускладнень, а також для контролю ефективності тромболітичної терапії.
Розроблено спосіб визначення анти-ІІа-факторної (непрямої протитромбінової) активності препаратів низькомолекулярного гепарину турбідиметричним методом із використанням плазми крові як джерела антитромбіну й фібриногену. Даний спосіб та тест-система на його основі можуть бути використані у фармацевтичній промисловості для контролю якості субстанцій та готових лікарських форм препаратів гепарину.
Особистий внесок здобувача. Дисертантом спільно з науковим керівником визначено головну ідею та завдання дослідження, розроблено підходи до розв’язання поставлених задач, сформульовано основні положення та висновки роботи. Здобувачем самостійно проведено пошук, систематизацію та аналіз даних літератури за темою дисертації, отримано та охарактеризовано основні протеїнові препарати, використані в роботі. Експериментальна частина дисертаційної роботи виконана автором особисто або за її безпосередньої участі. Математичну обробку, статистичний та кінетичний аналіз отриманих даних проведено автором дисертації. Всі розділи дисертації написані автором самостійно.
Аналіз та узагальнення результатів роботи, розробку модельних систем з використанням тромбоцитів проведено спільно з к.б.н. Жерносєковим Д.Д. Фрагменти плазміногену людини (К1-3, К4, К5 та мініплазміноген) отримано спільно з к.б.н. Юсовою О.І. та к.б.н. Капустяненко Л.Г., вивчення перетворення Glu-плазміногену на Lys-форму на поверхні активованих тромбоцитів – спільно з Юсовою О.І., дослідження актинового цитоскелету тромбоцитів – спільно з к.б.н. Тихомировим А.О. Розробку методу визначення анти-ІІа-факторної активності гепарину проведено спільно з к.б.н. Рибачук В.Н. Результати вищезгаданих досліджень опубліковано у спільних публікаціях.
Апробація результатів дисертації. Основні положення дисертації представлені на міжнародних конференціях та конгресах: Український біохімічний конгрес (м. Одеса, 2010 та м. Київ, 2014), Міжнародна конференція молодих науковців «Біологія: від молекули до біосфери» (м. Харків, 2011 та 2012), Міжнародна наукова конференція «Молодь та поступ біології» (м. Львів, 2012 та 2013), Науково-практична конференція «Молодые ученые в решении актуальных проблем науки» (м. Владикавказ, РФ, 2012, 2013 та 2014), Науково-практична конференція «Aktualneproblemynowoczesnychnauk» (м. Перемишль, Польща, 2012), Міжнародна конференція молодих вчених «Экспериментальная и теоретическая биофизика» (м. Пущино, РФ, 2012); Конференція-конкурс молодих вчених «Актуальні проблеми біохімії та біотехнології» (м. Київ, 2013 (ІІІ місце) та 2014), 38-й Конгрес FEBS «Mechanisms in Biology» (м. Санкт-Петербург, РФ, 2013), 17-та Міжнародна Пущинська школа-конференція молодих вчених «Биология – наука ХХІ века» (м. Пущино, РФ, 2013), ІІ Міжнародна конференція «Актуальні проблеми сучасної біохімії та клітинної біології» (м. Дніпропетровськ, 2013), IX Jakub K. Parnas Conference: Proteins from Birth to Death (м. Єрусалим, Ізраїль, 2013), II Міждисциплінарна конференція «Адаптаційні стратегії живих систем» (Новий Світ, АР Крим, 2014), І Конгрес «ВІО 2014» (м. Варшава, Польща, 2014), а також на науковому семінарі Інституту біохімії ім. О.В. Палладіна НАНУкраїни «Актуальні проблеми сучасної біохімії» (Київ, 2014). У 2010 та 2011 рр. наукові проекти за темою роботи були представлені на конкурсі Інституту на присудження стипендій імені видатних учених-біохіміків та стипендії дирекції Інституту біохімії (двічі відзначені стипендією дирекції Інституту).
Публікації. За результатами дослідження опубліковано 25 наукових робіт, які включають 6 статей, 1 патент України на винахід та 18 тез доповідей у матеріалах вітчизняних та закордонних науково-практичних конференцій, конгресів.
Структура та обсяг дисертації. Дисертація складається зі вступу, огляду літератури, матеріалів та методів досліджень, результатів досліджень та їх обговорення, заключення, висновків, списку використаних джерел (267 найменувань). Дисертаційна робота викладена на 164 сторінках машинописного тексту, проілюстрована 25 рисунками та 7 таблицями.
Перелік умовних скорочень. LBS – лізинзв’язувальні сайти, tPA – тканинний активатор плазміногену, PAI-1 – інгібітор активатора плазміногену 1 типу, 6-АГК –
6-аміногексанова кислота, ADP– аденозиндифосфат, БТП – безтромбоцитарна плазма, ЗТП – збагачена тромбоцитами плазма, Т540 nm– світлопропускання за λ = 540 нм,
НГ – нефракціонований гепарин, НМГ – низькомолекулярний гепарин.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Вступ.
У вступі висвітлено наукову проблему, обґрунтовано актуальність теми роботи, сформульовано мету і завдання дослідження, окреслено наукову новизну і практичне значення результатів, надано загальні відомості про обсяг дисертації.
Огляд літератури.
В огляді літератури систематизовано сучасні дані стосовно морфо-функціональної організації тромбоцитів, механізмів їх активації та агрегації. Наведено сучасні відомості про структуру та функції плазміноген/плазмінової системи. Висвітлено та проаналізовано інформацію щодо реципрокних регуляторних взаємодій між протеїнами плазміноген/плазмінової системи та тромбоцитами.
Матеріали та методи досліджень.
Кров умовно здорових донорів одержували в рамках співпраці з Центром крові Головного військового клінічного шпиталю Міністерства оборони України. Кров бика була надана ЗВП «Хутровик» (м. Узин, Україна). Glu-плазміноген людини одержували з цитратної плазми крові методом афінної хроматографії на лізин-сефарозі 4В за присутності інгібітора серинових протеїназ апротиніну [Deutsch, 1970]. Lys-плазміноген людини отримували за аналогічною методикою із фракції III2,3 плазми крові за Коном. Плазмін одержували шляхом активації плазміногену урокіназою, іммобілізованою на активованій BrCN сефарозі 4В [Norman, 1985]. Фрагменти плазміногену крингли 1-3 (К1-3), крингл 4 (К4) та Val 442-плазміноген (мініплазміноген) отримували шляхом обмеженого гідролізу плазміногену панкреатичною еластазою свині з наступними гель-хроматографією гідролізату на сефадексі G-75 та афінною хроматографією на лізин-сефарозі 4B[Sottrup-Jensen, 1977; Новохатний, 1985]. Фрагмент плазміногену крингл 5 (К5) отримували в результаті обмеженого протеолізу мініплазміногену пепсином свині та наступної хроматографічної очистки гідролізату на сефадексі G-75 та DEAE-сефадексі А-25 [Novokhatny, 1984; Thewes, 1987].Фібриноген одержували з цитратної плазми крові бика шляхом фракціонування сульфатом натрію за присутності соєвого інгібітора трипсину [Варецька, 1961]. DesAB-фібрин бика одержували активацією фібриногену тромбіном за присутності п-хлормеркурійбензоату натрію та 6-АГК [Варецька, 1965]. Чистоту одержаних протеїнів перевіряли методом електрофорезу в ПААГ за присутності SDS [Laemli, 1970]. Для ідентифікації Glu- та Lys-форм плазміногену застосовували електрофорез в ПААГ в системі сечовина/оцтова кислота за низьких значень рН [Panium, 1969]. Активність плазміну та потенційну активність плазміногену визначали за швидкістю вивільнення п-нітроаніліну з хромогенного субстрату S2251 (H-D-Val-L-Leu-L-Lys-п-нітроанілід).
Зразки ЗТП отримували центрифугуванням цитратної крові людини при 1000 об/хв протягом 20 хв за кімнатної температури. Нативні тромбоцити людини отримували із крові, антикоагульованої цитрат-декстрозним розчином (100 мМ лимоннокислий натрій, 80 мМ лимонна кислота, 110 мМ глюкоза), шляхом диференційного центрифугування за методикою [Gear, 2001]. Кількість клітин в зразках оцінювали за допомогою агрегометру «SOLAR AT-02» (Білорусь). Лізати інтактних тромбоцитів отримували шляхом їх обробки детергент-вмісним буфером (50мМ трис-НСl, рН-7,4, що містив 0,2% тритон Х-100, 50 мМ NaCl, 1 мМ MgCl2, 1 мМ етилендиамінотетраоцтову кислоту) [Brogren, 2008]. Для стимуляції секреції РАІ-1 тромбоцитами було взято тромбін (1 од. NIH/мл) та колаген (1,25 мг/мл). Через 5 хв тромбоцити осаджували центрифугуванням 4000 об/хв протягом 20 хв за 4°С. Супернатант, що містив продукти секреції тромбоцитів (релізат), зберігали при
-20°С. Фракцію мембран тромбоцитів отримували після обробки клітин розчином 0,2% NaCl за 4°С та наступного центрифугування 13000 об/хв протягом 10 хв. Осад мембран тромбоцитів використовували в подальших експериментах протягом дня.
Зразки БТП крові людини для визначення активності РАІ-1 отримували центрифугуванням цитратної крові протягом 20 хв при 4000 об/хв за 4°С [Brogren, 2008]. Активність РАІ-1 в зразках плазми крові, лізатах інтактних тромбоцитів та продуктах секреції активованих тромбоцитів визначали запропонованим нами амідолітичним методом із використанням desAB-фібрину бика як стимулятора та хромогенного субстрату плазміну S2251 [Рока-Мойя, 2013].
Кінетику активації плазміногену тканинним активатором досліджували в безклітинній системі, що містила 100 МО/мл tPA, 0,2-2 мкМ Glu-плазміногену,
0,3 мМ S2251 у 0,05 М трис-HCl буфері (рН 7,4) із додаванням 0,1 М NaCl,
0,01% твін-80 за кімнатної температури. При дослідженні активації плазміногену за присутності тромбоцитів (інтактних або активованих тромбіном) в реакційній системі містилося 12 МО/мл tPA, 0,2-2 мкМ Glu-плазміногену, 0,3 мМ S2251 у 0,05 М трис-HCl буфері (рН 7,4) із додаванням 0,1 М NaCl. Для активації плазміногену використовували одноланцюговий рекомбінантний tPA (ін’єкційний препарат «Актилізе», Boehringer Ingelheim International GmbH, Німеччина). Швидкість активації плазміногену визначали як середній приріст величини адсорбції (ΔA*10-3/хв, λ1 = 405 нм та λ2 = 492 нм) на висхідній лінійній ділянці кінетичних кривих, що відповідає 15-30 хв реакції активації [Макогоненко, 1997], та виражали у одиницях оптичної густини за секунду (OD·10-3/с). Константу Міхаеліса (Km) та максимальну швидкість (Vmax) визначали графічним методом в координатах Хайнса-Вульфа. Для вираження величини максимальної швидкості реакції активації в нМ плазміну, що утворюється за одиницю часу, отримане значення швидкості (в OD*10-3/с) множили на коефіцієнт пропорційності, виходячи з розрахунку, що 1 нМ розчин плазміну забезпечує приріст оптичної густини 0,01 OD/хв (λ = 405 нм, 25°С) [Beckmann, 1988].
Агрегацію тромбоцитів досліджували у препаратах 3ТП крові та суспензії відмитих тромбоцитів людини на оптичному агрегометрі «SOLAR AT-02» (Білорусь) за протоколом [Зубовская, 2010]. Кількість тромбоцитів в зразках становила 300-350 тис. клітин/мкл. Агрегацію тромбоцитів стимулювали внесенням ADP (5 мкМ), тромбіну (1 од. NIH/мл), колагену (1,25 мг/мл) або ристоміцину (1,5 мг/мл) та реєстрували в кінетичному режимі протягом 5 хв. Аналіз даних агрегометрії проводили із використанням пакету програм «Агрегометр 2.01», ступінь та швидкість агрегації реєструвалися автоматично. Ступінь агрегації (Тmax) – це максимальне значення світлопропускання (Т, λ = 540 нм) реакційної суміші, що досягається через 5 хв після додавання індуктора агрегації; швидкість агрегації – це тангенс кута нахилу дотичної до заданої ділянки агрегаційної кривої до осі абсцис. Перед внесенням агоніста агрегації зразки передінкубували з Glu-, Lys-плазміногеном, плазміном, фрагментами плазміногену (К1-3, К4, К5, мініплазміноген) або препаратами гепарину протягом 3 хв для забезпечення їх взаємодії з клітинною поверхнею. Стандартизацію препаратів низькомолекулярного гепарину за анти-ІІа-факторною активністю проводили із використанням запропонованого нами способу [Пат. UA № 98552 С2].
Протеїнові фракції тромбоцитів, що містять різні пули актину, отримували після руйнування клітин за допомогою детергентвмісного буфера та наступного диференційного центрифугування, як описано в роботі [Díaz-Ricart, 2000]. Так, до суспензії тромбоцитів вносили рівний об’єм буфера для лізису (0,1 М трис-HCl
(рН 7,4), що містив 2% тритон X-100, 10 мМ етиленглікольтетраоцтову кислоту, 2 мкг/мл лейпептину, 0,1 М бензамідин, 2 мМ фенілметилсульфонілфторид,
2 мМ ванадат натрію) та ресуспендували. Лізати тромбоцитів центрифугували при 15000g протягом 4 хв. Отриманий осад, що нерозчинний у буфері з тритоном X-100, містив фракцію фібрилярного актину. Для відокремлення пулу глобулярного актину від актину мембранного кортексу супернатант центрифугували при 100000g протягом 2год. Осад, отриманий після високошвидкісного центрифугування, містив фракцію актину мембранного кортексу. Пул глобулярного актину, солюбілізованого у тритон X-100-вмісному буфері, залишався у супернатанті. Всі етапи центрифугування проводили при 4°С. Електрофоретичне розділення протеїнів у зразках актинвмісних фракцій тромбоцитів проводили з урахуванням рекомендацій [Brunso, 2010].
Детекцію пулів актину у складі протеїнових фракцій тромбоцитів проводили методом імуноблотингу відповідно до загальноприйнятої методики [Towbin, 1979]. Відносний вміст різних пулів актину у тромбоцитах оцінювали денситометрично із використанням програми «Total Lab - 120» (США) і виражали у відсотках від кількості фібрилярного актину у досліджуваній групі клітин.
Математичну обробку, статистичний та кінетичний аналіз отриманих експериментальних даних виконували за допомогою пакету програм «МS Excel». До роботи включено результати експериментів, допустима похибка яких не перевищувала 5 відсотків (р < 0,05). Представлені на рисунках дані є типовими для серій повторюваних дослідів (не менше трьох у кожній серії).
Результати досліджень та їх обговорення.
Активація Glu-плазміногену тканинним активатором плазміногену за присутності тромбоцитів. Для з’ясування закономірностей процесу активації плазміногену на поверхні інтактних тромбоцитів проведений порівняльний кінетичний аналіз реакції активації проензиму tPA за присутності тромбоцитів людини до та після їх стимуляції тромбіном. Концентрації плазміногену та тромбоцитів в реакційному середовищі були близькими до фізіологічних. Значення кінетичних констант активації плазміногену в безклітинній системі та за присутності тромбоцитів отримували графічним методом в координатах Хайнса-Вульфа й обчислювали, як описано в розділі «Матеріали та методи досліджень». Встановлено, що неактивовані тромбоцити у концентрації 0,8 - 8·106 клітин/мл значно прискорюють процес активації плазміногену tPA. Стимуляція активації зимогену неактивованими та активованими тромбоцитами є наслідком зростання спорідненості tPA до його субстрату – плазміногену, про що свідчить зниження константи Міхаеліса у 8 та 18 разів, відповідно, у порівнянні з безклітинною системою (табл. 1). Каталітична константа реакції зростає незначно. Ймовірно, підвищення ефективності каталізу в ряду «неактивовані тромбоцити → активовані тромбоцити» є наслідком анонсованої в літературі інтенсифікації зв’язування плазміногену на поверхні тромбоцитів після їх стимуляції
Таблиця 1.
Кінетичні параметри активації Glu-плазміногену тканинним активатором
плазміногену за присутностітромбоцитів(М± m, n = 6)
|
Показники Групи |
Km, мкМ | kcat, с-1 | kcat/Km, мкМ-1·с-1 |
| Без тромбоцитів | 1,117± 0,086 | 0,021± 0,002 | 0,0188 |
| Неактивовані тромбоцити | 0,184± 0,066* | 0,029± 0,008 | 0,157* |
| Активовані тромбоцити | 0,061± 0,003* | 0,039± 0,01 | 0,639* |
Примітка: відмінності у порівнюваних групах є статистично вірогідними (р < 0,05): * - порівняно з показниками групи «Без тромбоцитів».
тромбіном [Miles, 1985]. Таким чином, показано підвищення ефективності каталізу реакції активації плазміногену tPA за участі тромбоцитів.
Визначення активності інгібітора активатора плазміногену 1 типу в тромбоцитах та плазмі крові. РАІ-1 є основним фізіологічним інгібітором tPA та урокінази. РАІ-1 синтезується різними типами клітин та тканин, проте близько 90 % від загального вмісту інгібітора в крові зосереджено в a-гранулах тромбоцитів. На сьогодні остаточно не з’ясована участь тромбоцитарного пулу РАІ-1 у регуляції активності плазміноген/плазмінової системи. За даними масштабних клінічних досліджень підвищення вмісту та активності РАІ-1 в плазмі крові є незалежним фактором ризику гострих серцевих патологій у здорових осіб, хворих на серцево-судинні та метаболічні захворювання, а також виступає прогностичним маркером тромботичних ускладнень у післяопераційний період [Takazoe, 2001; Smith, 2005; Akkus, 2009; Bollen, 2014].
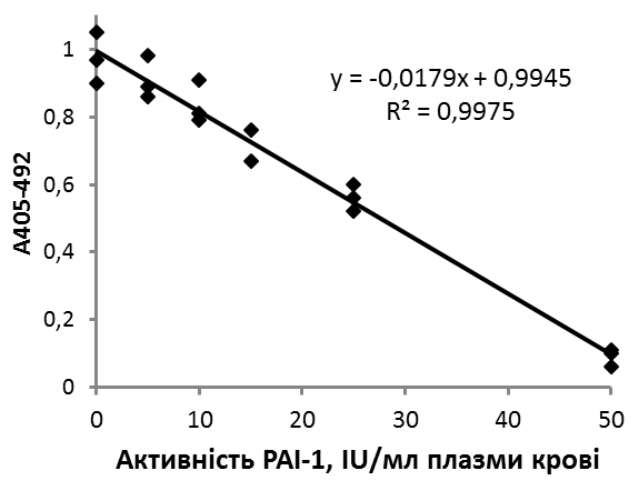 Рис. 1.Калібрувальна крива для визначення активності РАІ-1 амідолітичним методом з використанням desАВ-фібрину бика як стимулятора.
|
Запропоновано кількісний метод визначення активності РАІ-1 в плазмі крові та тромбоцитах людини, принцип якого базується на інгібуванні серпіном реакції активації плазміногену tPA із використанням desАВ-фібрину бика як стимулятора. Результати валідації свідчать про те, що метод характеризується високою точністю, відтворюваністю, специфічністю та дозволяє визначати активність РАІ-1 в широких межах (рис. 1), а також є економним та простим у виконанні. Результуючі значення активності РАІ-1 в зразках БТП крові умовно здорових донорів є близькими до таких, що були визначені за допомогою інших функціональних методів авторами робіт [Speiser, 1986; Chandler, 1989]. Отже, даний метод визначення активності РАІ-1 може бути використаний в лабораторно-клінічній практиці для оцінки рівня функціонально активного РАІ-1 в плазмі крові хворих під час діагностики тромботичних ускладнень та контролю ефективності медикаментозного і оперативного лікування серцево-судинних патологій.
Для з’ясування ролі тромбоцитарного пулу РАІ-1 в регуляції активності плазміноген/плазмінової системи визначали інгібіторну активність РАІ-1 у плазмі крові (БТП і ЗТП) та відмитих тромбоцитах людини із використанням запропонованого методу. Виявили, що після додавання до ЗТП агоніста активації тромбоцитів ADP та наступного видалення тромбоцитарних агрегатів, активність
РАІ-1 у безтромбоцитарній фракції плазми зростає (табл. 2, група «БТП після активації тромбоцитів АDP», порівняно з групою «БТП крові»), що вказує на вивільнення активної форми інгібітора тромбоцитами. Оцінка активності РАІ-1 в лізатах інтактних тромбоцитів та релізатах активованих тромбоцитів дозволяє стверджувати, що тромбоцити містять в собі значний резерв активної форми інгібітора (близько 2 МО/108 клітин), який здатен ефективно пригнічувати процес активації плазміногену tPA та секретується в середовище агрегації при дії агоністів активації – тромбіну і колагену (див. табл. 2).
Рівень функціонально активного РАІ-1 тромбоцитів може розглядатися як додатковий діагностичний критерій при оцінці ризику виникнення супутніх тромбозів та геморагій за ряду патологічних станів (інфаркт міокарду, гіпертензія, діабет, алкогольний цироз печінки, терапія антикоагулянтними препаратами гепарину), що супроводжуються системною активацією тромбоцитів.
Таблиця 2.
Активність РАІ-1 у фракціях плазми крові та тромбоцитах (М± m; n = 15)
|
Показники Групи |
Активність РАІ-1 плазми крові, |
Показники Групи |
Активність РАІ-1 МО/108 клітин |
| БТП крові | 25,18 ± 4,75 | Лізат інтактних тромбоцитів | 2,04 ± 0,70 |
| ЗТП крові | 31,98 ± 8,23 | Релізат активованих тромбоцитів (тромбін) | 1,26 ± 0,60 |
| БТП після активації тромбоцитів АDP | 40,30±7,35 | Релізат активованих тромбоцитів (колаген) | 0,75 ± 0,36 |
Таким чином, доведено, що тромбоцити відіграють важливу роль у регуляції плазміноген/плазмінової системи: вони містять в собі значний резерв функціонально активного РАІ-1, а також можуть виступати осередками активації плазміногену та локальної генерації плазміну. Не виключено, що мембраноасоційований плазмін, котрий захищений від дії інгібіторів плазми, буде розщеплювати ряд просторово наближених субстратів, зокрема власне плазміноген. Серед продуктів обмеженого протеолізу плазміногену окремої уваги вартий Lys-плазміноген. Lys-плазміноген, на відміну від нативної Glu-форми, має відкриту конформацію, з експонованими LBS кринглових доменів, тому може розглядатися як мультивалентний адгезивний ліганд. Надалі досліджували вплив Glu- та Lys-форм плазміногену на агрегацію тромбоцитів, стимульовану різними агоністами.
Вплив екзогенного Glu- та Lys-плазміногену на агрегацію тромбоцитів. Ефекти плазміногену на агрегацію тромбоцитів людини досліджували методом оптичної агрегометрії із використанням 2-х модельних систем – ЗТП крові та відмитих тромбоцитів. Виявили, що Lys-плазміноген, на відміну від повнорозмірної Glu-форми, пригнічує другу необоротну стадію ADP-індукованої агрегації тромбоцитів плазми крові (рис. 2, А). Подібний антиагрегаційний ефект чинить DD-фрагмент фібрину (рис. 2, Б), котрий, як відомо, конкурує з фібриногеном за його інтегриновий рецептор αIIbβ3 на тромбоцитарній поверхні та перешкоджає формуванню міжтромбоцитарних контактів. Ймовірно, інгібування агрегації Lys-плазміногеном також є наслідком його взаємодії з протеїнами, що експонуються на поверхні тромбоцитів під час активації.
А Б
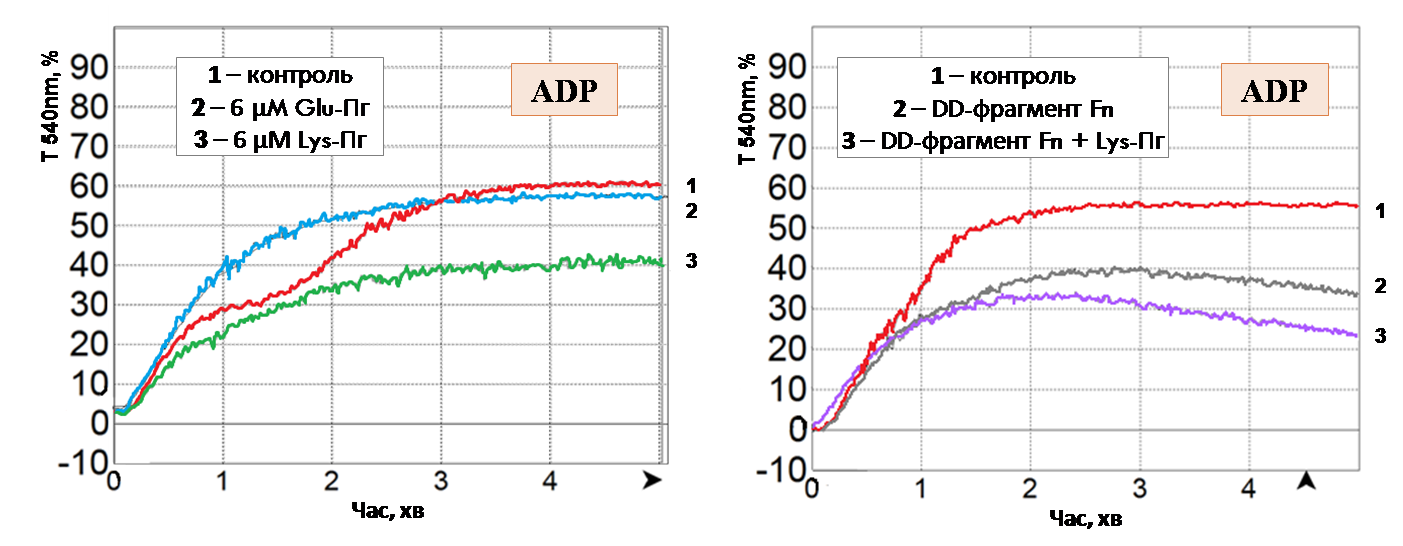
Рис. 2. Вплив Glu-, Lys-плазміногену (А) та DD-фрагменту фібрину (Б) на агрегацію тромбоцитів в плазмі крові (індуктор – 5 мкМ ADP). «Контроль» – агрегація тромбоцитів, стимульованих ADP, Т540 nm– світлопропускання за λ = 540 нм.
Дане припущення знайшло своє підтвердження за використання відмитих тромбоцитів. В модельній системі відмитих тромбоцитів Lys-плазміноген виявляє потужну інгібувальну дію, щонайменше вдвічі знижуючи ступінь агрегації тромбоцитів, стимульованих сильними агоністами – тромбіном та колагеном (рис. 3, А, Б). На прикладі тромбін-індукованої агрегації показаний дозозалежний характер інгібування з тенденцією до насичення в області мікромолярних концентрацій (рис 3, В), що вказує на специфічну взаємодію проензиму з обмеженим числом сайтів зв’язування на тромбоцитарній поверхні. Також встановлено, що ристоміцин-індукована аглютинація тромбоцитів не пригнічується Lys-плазміногеном (рис. 3, Г). Ймовірно, виявлена селективність дії проензиму продиктована молекулярним механізмом агрегації того чи іншого типу: Lys-плазміноген інгібує агрегацію, що опосередкована взаємодією β3-інтегринів з їх лігандами та не впливає на GP Іb-залежну ланку агрегації. На основі даних агрегометрії можна зробити висновок про те, що Lys-плазміноген, на відміну від Glu-плазміногену, який циркулює в плазмі крові, виявляє потужну антиагрегаційну дію.
А Б
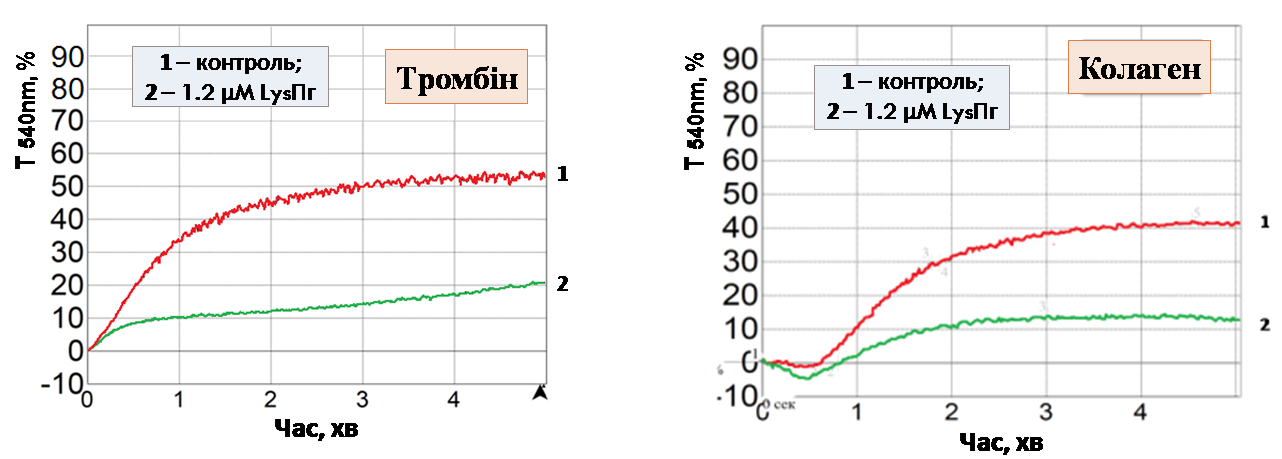
В Г
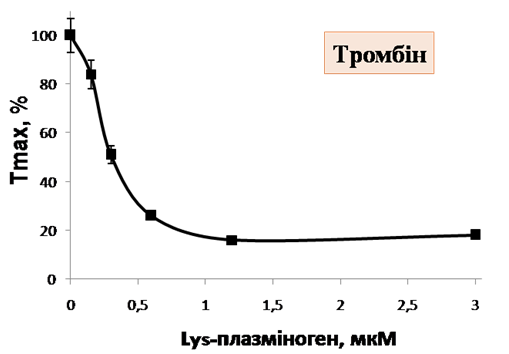
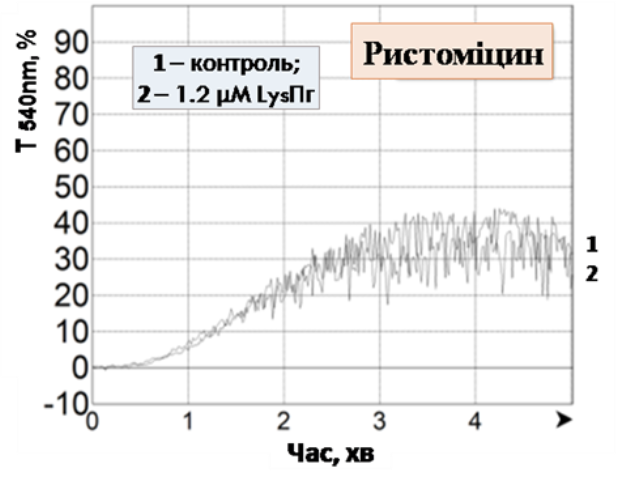
Рис. 3. Вплив Lys-плазміногену на агрегацію тромбоцитів, стимульованих тромбіном (А, В), колагеном (Б) та ристоміцином (Г): «Контроль» – агрегація тромбоцитів, стимульованих відповідним індуктором, Т540 nm– світлопропускання за λ = 540 нм.
В – інгібування агрегації тромбоцитівзарізних концентрацій Lys-плазміногену, де ступінь контрольної тромбін-індукованої агрегації прийнято за 100%, Тmax– ступінь агрегації (n =3).
Тому надалі необхідно було з’ясувати, чи може Glu-плазміноген перетворюватися на Lys-форму на тромбоцитарній поверхні. Після інкубації інтактних тромбоцитів з Glu-плазміногеном та подальшої активації тромбіном одержували фракцію плазматичних мембран цих клітин. Сорбований на мембранах плазміноген елюювали специфічним лігандом – 6-АГК. За аналогічним протоколом отримували протеїнові фракції-елюати з мембран інтактних тромбоцитів до та після обробки клітин Glu-плазміногеном. В елюатах оцінювали амідолітичну активність плазміногену щодо хромогенного субстрату плазміну S2251 з використанням стрептокінази як специфічного активатора (рис. 4, А), а також визначали форму зимогену за даними електрофорезу за низьких значень рН (рис. 4, Б). Детекція амідолітичної активності в зразках протеїнових фракцій, що елюйовані 6-АГК з мембран тромбоцитів, вказує на специфічну сорбцію плазміногену на клітинній поверхні. Слід підкреслити, що амідолітична активність 6-АГК-елюату активованих тромбоцитів в 4,6 рази перевищує таку в елюаті неактивованих клітин, що були оброблені Глу-плазміногеном (рис. 4, А, групи «Активовані Тц + Glu-Пг» та «Інтактні Тц + Glu-Пг», відповідно). Отже, тромбін-індукована активація тромбоцитів супроводжується експонуванням додаткових сайтів зв’язування плазміногену. На основі результатів електрофорезу можна стверджувати, що асоційований з мембранами активованих тромбоцитів плазміноген представлений Lys-формою (рис. 4, Б).
А Б
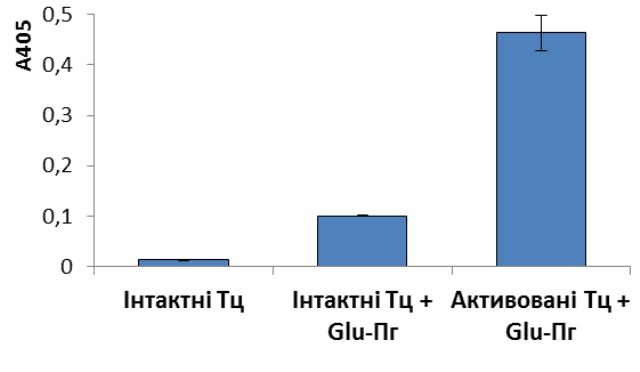
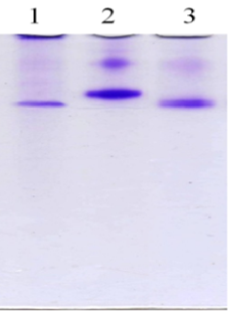
|
Рис. 4. Детекція плазміногену в протеїнових фракціях, що елюйовані 6-АГК з мембран тромбоцитів людини: А – амідолітична активність елюатів мембран тромбоцитів (n = 3); Б – електрофореграма препаратів плазміногену: 1 – Lys-плазміноген, елюйований 6-АГК з мембран активованих тромбоцитів; 2 – контрольний зразок Glu-плазміногену; 3 – контрольний зразок Lys-плазміногену. |
Таким чином, встановлено, що Lys-плазміноген, на відміну від Glu-плазміногену, інгібує агрегацію тромбоцитів, що індукується ADP, тромбіном та колагеном. Ристоміцин-залежна аглютинація тромбоцитів не пригнічується Lys-плазміногеном, що вказує на селективність його дії щодо механізму агрегації. Вірогідно, виявлений ефект Lys-плазміногену є наслідком його взаємодії з інтегриновими рецепторами β3-родини та/або їх лігандами (вітронектин, фібриноген, тромбоспондин), що експонуються під час активації тромбоцитів та залучаються до утворення міжтромбоцитарних взаємодій під час агрегації. Експериментально доведено, що екзогенний Glu-плазміноген, який специфічно зв’язується з поверхнею тромбін-активованих тромбоцитів, може перетворюватися на Lys-форму зимогену.
Вплив антикоагулянтних препаратів гепарину на агрегацію тромбоцитів та ефекти плазміногену щодо агрегації тромбоцитів. Препарати гепарину є сучасними ефективними лікарськими засобами для профілактики та терапії тромботичних станів. Антикоагулянтна дія гепарину є наслідком його зв’язування з протеїном плазми крові антитромбіном та наступного інгібування тромбіну та фактору згортання крові Ха комплексом «антитромбін - гепарин». Ефективність препаратів гепарину обмежена наявністю побічних ефектів, таких як тромбоцитопенія та локальні тромбози. Тому модулююча дія гепарину на тромбоцитарну ланку гемостазу є предметом посиленого інтересу не лише науковців, а й медиків. Для моделювання дії гепарину на агрегацію тромбоцитів в роботі були використані такі препарати: субстанція нефракціонованого гепарину (НГ) (анти-Ха-факторна активність – 166 МО/мг, Mm= 16 кДа), низькомолекулярний гепарин (НМГ) (ін’єкційний препарат «Фраксипарин», анти-Ха-факторна активність – 9500 МО/мл, Mm= 4,3 кДа) та синтетичний пентасахарид фондапаринукс (ін’єкційний препарат «Арікстра», 5 мкг/мл, Mm = 1,7 кДа) виробництва Glaxo Wellcome Production, Франція. Означені препарати гепарину різняться між собою за довжиною олігосахаридних ланцюгів та, відповідно, адгезивними властивостями. Встановлено, що досліджувані форми гепарину у концентрації, близькій до терапевтичної, не викликають спонтанної агрегації та не впливають на ADP-індуковану агрегацію тромбоцитів в ЗТП: ступінь та швидкість агрегації достовірно не відрізняються від контролю (рис. 5). Несподіваною була відсутність потенціюючої дії навіть у високомолекулярних ланцюгів НГ, який є найбільш адгезивним серед
 Рис. 5. Вплив препаратів гепарину на агрегацію тромбоцитів в плазмі крові (індуктор агрегації – 5 мкМ ADP). «Контроль» – агрегація тромбоцитів, стимульованих ADP, Т540 nm– світло-пропускання за λ = 540 нм.
|
досліджуваних препаратів. Разом з тим показано, що після нетривалої експозиції ЗТП з 1 МО/мл НГ спостерігається вивільнення тромбоцитами пулу РАІ-1 в середовище плазми, про що свідчить зростання рівня функціонально активного РАІ-1 в плазмі крові за умов експерименту з 36,77 ± 1,82 МО/мл до 52,24 ± 4,32 МО/мл, відповідно (М ± m; n = 3). Цей факт дозволяє стверджувати, що навіть за терапевтичних концентрацій в плазмі крові гепарин є модулятором тромбоцитарних функцій і може індукувати помірну активацію тромбоцитів з наступним вивільнення вмісту їх секреторних гранул.
Беручи до уваги здатність гепарину зв’язуватися з протеїнами тромбоцитарної поверхні та компонентами плазміноген/плазмінової системи, дослідили вплив препаратів гепарину на ефекти плазміногену щодо агрегації тромбоцитів.З’ясували, що інгібування швидкості та ступеня агрегації тромбоцитів плазми Lys-плазміногеном залишається незмінним за терапевтичних концентрацій всіх досліджуваних форм гепаринів (рис. 6). Толерантність Glu-плазміногену щодо агрегації також не зазнає достовірних змін.
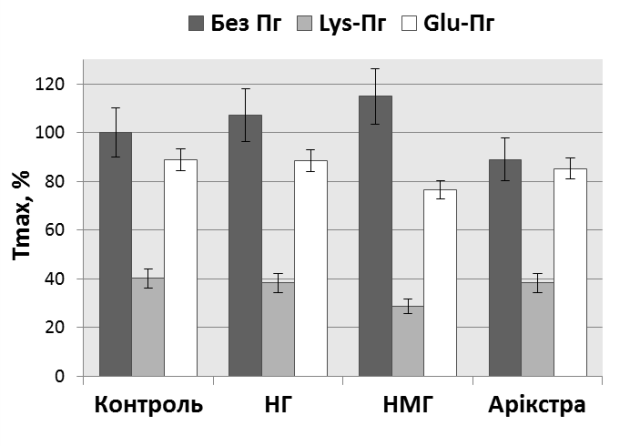 Рис. 6. Вплив НГ (1 МО/мл), НМГ (1 МО/мл) та пентасахариду «Арікстра» (1 мкг/мл) на ефекти плазміногену щодо агрегації ЗТП крові (n = 4). На гістограмі за 100% прийнято ступінь контрольної агрегації, індуктор – 5 мкМ ADP, Тmax– ступінь агрегації. Рис. 6. Вплив НГ (1 МО/мл), НМГ (1 МО/мл) та пентасахариду «Арікстра» (1 мкг/мл) на ефекти плазміногену щодо агрегації ЗТП крові (n = 4). На гістограмі за 100% прийнято ступінь контрольної агрегації, індуктор – 5 мкМ ADP, Тmax– ступінь агрегації. |
Отже, антикоагулянтні препарати гепарину у терапевтичній концентрації не індукують спонтанної агрегації тромбоцитів та не впливають на ADP-індуковану агрегацію тромбоцитів в плазмі крові. НГ може викликати помірну активацію та вивільнення тромбоцитами РАІ-1. НГ, НМГ та пентасахарид фондапаринукс не чинять модулюючого впливу на ефекти Glu- та Lys-плазміногену щодо агрегації тромбоцитів.
Вплив плазміногену на перебудову актинового цитоскелету тромбоцитів за їх активації. Під час активації тромбоцитів відбувається зміна їх форми, адгезивних властивостей та вивільнення секреторних гранул. В основі означених процесів лежить перебудова цитоскелету цих клітин. Активація тромбоцитів тромбіном і колагеном викликає полімеризацію глобулярного актину (G-актину) з утворенням фібрил (F-актину) та об’єднання фібрилярного апарату цитоплазми з актином мембранного кортексу (МС). Свідченням агоніст-індукованої інтенсифікації фібрилогенезу на імуноблоті актинвмісних протеїнових фракцій активованих тромбоцитів є значне зменшення часток G- та МС-актину, практично весь актин представлений F-формою (рис. 7, групи «Тромбін» та «Колаген», порівняно з групою «Інтактні Тц»). Показано, що інкубація інтактних тромбоцитів з Lys-плазміногеном, яка передує дії агоністів, перешкоджає реорганізації актинового цитоскелету, на що вказують високі, як для активованих тромбоцитів, рівні G-актину та актину МС (рис. 7, групи
«Lys-Пг+Тромбін» та «Lys-Пг+Колаген»). Отримані дані щодо впливу Lys-плазміногену на процес реорганізації цитоскелету тромбоцитів під час активації, узгоджуються з результатами агрегометричного аналізу. Таким чином, встановлено, що Lys-плазміноген перешкоджає перебудові актинового цитоскелету тромбоцитів, стимульованих тромбіном та колагеном, що може бути одним із механізмів антиагрегаційної дії Lys-плазміногену.
А
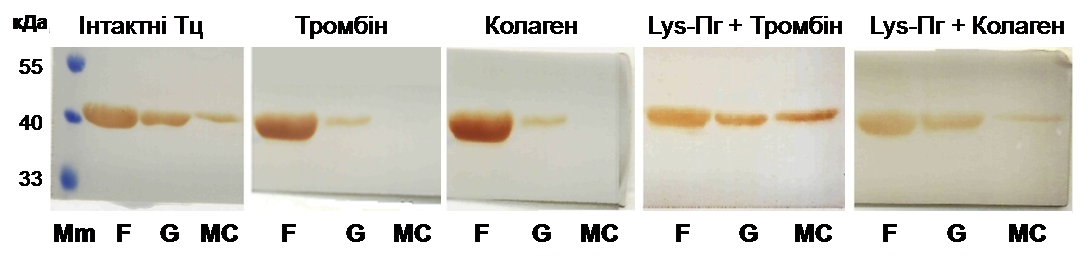
Б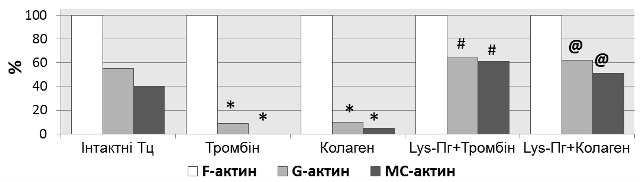
Рис. 7. Вплив Lys-плазміногену на перебудову актинового цитоскелету тромбоцитів за їх активації тромбіном і колагеном: А – імуноблот актинвмісних протеїнових фракцій інтактних та активованих тромбоцитів, Б – відносний вміст форм актину тромбоцитів у протеїнових фракціях (* –P <0,05 порівняно з групою «Інтактні Тц», # –P < 0,05 порівняно з групою «Тромбін», @ –P < 0,05 порівняно з групою «Колаген»): Mm – маркери молекулярної маси, F – філаментний актин, G – глобулярний актин,
MC – актин мембранного кортексу, Тц – тромбоцити.
Роль окремих доменів молекули плазміногену у забезпеченні його інгібувального ефекту на агрегацію тромбоцитів. Щоб з’ясувати, який структурний компонент молекули плазміногену – cеринпротеїназний домен чи кринглові структури – відповідає за його антиагрегаційну дію, проведено ряд наступних експериментів. Визначення амідолітичної активності в середовищі, що містило інтактні тромбоцити людини (300-350 тис. клітин/мкл) та 1,2 мкМ Lys-плазміноген, показало наявність 1,2 нМ плазміну через 15 хв інікубації. Для пригнічення каталітичної активності плазміну в середовищі агрегації використовували інгібітор серинових протеїназ апротинін (5,5 МО/мл). Показано, що зниження ступеню та швидкості тромбін-індукованої агрегації під впливом Lys-плазміногену має місце за присутності апротиніну (табл. 3). Власне апротинін не чинив ефекту на агрегацію тромбоцитів. Крім того, було встановлено, що екзогенний плазмін в наномолярній концентрації не впливає на агрегацію тромбоцитів людини. Отже, в експериментах з апротиніном та екзогенним плазміном, участь серинпротеїназного домену в реалізації інгібувального ефекту Lys-плазміногену не виявлена.
Таблиця 3.
Вплив плазміну та апротиніну на інгібування Lys-плазміногеном агрегації тромбоцитів, що стимульована тромбіном (М ± m; n = 6)
|
Показники Групи |
Максимальна амплітуда агрегації, % |
Швидкість агрегації на 30 с, %/хв |
| Контрольна агрегація | 44,60 ± 9,51 | 18,25 ± 6,23 |
| 1,2 мкМ Lys-плазміноген | 17,7 ± 2,51* | 7,42 ± 5,47* |
| 5,5 МО/мл апротинін | 45,36 ± 5,68 | 18,00 ± 5,19 |
| 1,2 мкМ Lys-плазміноген + 5,5 МО/мл апротинін |
15,75 ± 4,35* | 5,20 ± 1,06* |
| 1,2 нМ плазмін | 42,6 ± 3,36 | 17,26 ± 4,88 |
Примітка. Відмінності у порівнюваних групах є статистично значимими (р<0,05): * - порівняно з показниками «Контрольної агрегації».
Міжмолекулярні взаємодії плазміногену реалізуються за участі LBS, що розташовані в його кринглових доменах. Аналог лізину 6-АГК блокує LBSзимогену й порушує такі взаємодії. Встановлено, що в концентраціях 0,05 - 0,5 мМ 6-АГК послаблює антиагрегаційний ефект Lys-плазміногену, тоді як за присутності 1 мМ 6-АГК зниження ступеня тромбін-індукованої агрегації за дії Lys-плазміногену не спостерігається (рис. 8). 6-АГК виявляє подібний ефект на інгібування Lys-плазміногеном агрегації тромбоцитів, стимульованих колагеном. Діапазон діючих концентрацій 6-АГК вказує на залучення до взаємодії «плазміноген - тромбоцит» LBS високої та низької афінності.
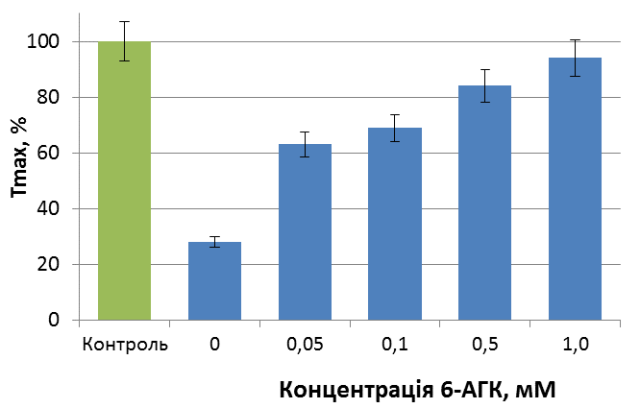 Рис. 8. Інгібування Lys-плазміногеном агрегації тромбоцитів за присутності 6-аміногексанової кислоти (n = 3). Контроль – тромбін-індукована агрегація, Тmax– ступінь агрегації. Рис. 8. Інгібування Lys-плазміногеном агрегації тромбоцитів за присутності 6-аміногексанової кислоти (n = 3). Контроль – тромбін-індукована агрегація, Тmax– ступінь агрегації. |
Було отримано ряд кринглвмісних фрагментів плазміногену людини: К1-3, К4, К5 та мініплазміноген, який складається з К5 і серинпротеїназного домену плазміногену. Встановлено, що передінкубація неактивованих тромбоцитів з фрагментами К1-3, К4 або К5 в концентрації, еквімолярній такій зимогену, перешкоджає інгібуванню Lys-плазміногеном агрегації тромбоцитів, стимульованих тромбіном (рис. 9). Цікаво відмітити, що фрагмент плазміногену К5 вже у концентрації 0,12 мкМ відновлює ступінь агрегації тромбоцитів на 90%, тоді як К1-3 та К4 – лише наполовину від контрольного рівня. Окремі фрагменти плазміногену (К1-3, К4, К5 та мініплазміноген) не впливають на тромбін-індуковану агрегацію тромбоцитів. Отже, кринглові домени є необхідними для антиагрегаційного ефекту Lys-плазміногену, який, ймовірно, обумовлений взаємодією зимогену з протеїнами, що експонуються на поверхні тромбоцитів при активації та залучаються до процесу агрегації. Отримані результати та аналіз даних літератури дозволяють запропонувати на роль рецепторів плазміногену на поверхні тромбоцитів деякі інтегрини β3-родини (αІІbβ3 та αVβ3), а також ряд плазміноген-зв’язувальних протеїнів (фібриноген, вітронектин, тромбоспондин), які секретуються активованими тромбоцитами та забезпечують формування міжтромбоцитарних контактів при агрегації.
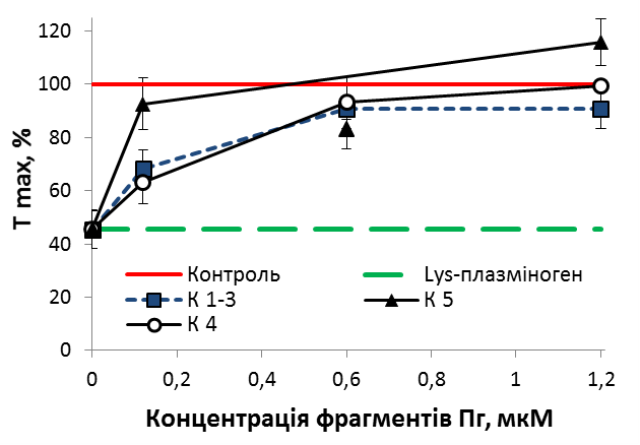 Рис. 9. Інгібування Lys-плазміногеном агрегації тромбо-цитів за присутності крингл-вмісних фрагментів плазміногену К1-3, К4 та К5 (n =4). Контроль – тромбін-індукована агрегація, Тmax– ступінь агрегації. Рис. 9. Інгібування Lys-плазміногеном агрегації тромбо-цитів за присутності крингл-вмісних фрагментів плазміногену К1-3, К4 та К5 (n =4). Контроль – тромбін-індукована агрегація, Тmax– ступінь агрегації. |
Результати дисертаційної роботи дозволяють стверджувати, що тромбоцити відіграють важливу роль у регуляції активності плазміноген/плазмінової системи.Вони накопичують та вивільняють значну кількість функціонально активного РАІ-1, що здатний пригнічувати процес активації плазміногену. Разом з тим тромбоцити сприяють активації плазміногену та локальній генерації плазміну. Lys-плазміноген, який може утворюватися на тромбоцитарній поверхні, виявляє потужну антиагрегаційну дію та запобігає агоніст-індукованій реорганізації актинового цитоскелету тромбоцитів. Антиагрегаційний ефект Lys-плазміногену потребує щонайменше двоцентрової взаємодії LBS кринглових доменів проензиму з мембраноасоційованими протеїнами тромбоцитів. Таким чином, встановлено, що плазміноген/плазмінова система обмежує агрегаційну здатність тромбоцитів і тим самим залучається до регуляції їх функціонального стану.
ВИСНОВКИ
У дисертаційній роботі досліджено реципрокні регуляторні взаємодії між протеїнами плазміноген/плазмінової системи та тромбоцитами. Експериментально доведено, що плазміноген/плазмінова система регулює функціональний стан тромбоцитів, обмежуючи їх агрегаційну здатність. Показано, що тромбоцити безпосередньо залучаються до регуляції активності плазміноген/плазмінової системи. Вони виступають поверхнею для активації плазміногену і локальної генерації плазміну, а також секретують активну форму РАІ-1, що пригнічує процес активації плазміногену.
- Встановлено, що тромбоцити підвищують ефективність каталізу реакції активації плазміногену tPA. За присутності неактивованих та активованих тромбоцитів підвищується спорідненість tPA до плазміногену, про що свідчить зниження Km у 8 та 18 разів, відповідно.
- Розроблено та валідовано кількісний метод визначення активності РАІ-1 із використанням desAB-фібрину бика як стимулятора активації плазміногену. Запропонований метод характеризується високою точністю, відтворюваністю, специфічністю та дозволяє визначати рівень активної форми РАІ-1 в плазмі крові та тромбоцитах. Встановлено, що РАІ-1, який вивільняється при агрегації тромбоцитів, стимульованих тромбіном та колагеном, знаходиться в активній формі та здатний пригнічувати активацію плазміногену tPA.
- Вперше встановлено, що Lys-плазміноген, на відміну від Glu-плазміногену та окремих кринглвмісних фрагментів плазміногену, інгібує другу необоротну стадію агрегації тромбоцитів плазми, індуковану ADP, та агрегацію відмитих тромбоцитів, стимульовану тромбіном і колагеном. Водночас ристоміцин-залежна аглютинація тромбоцитів не пригнічується Lys-плазміногеном, що вказує на селективність дії зимогену щодо механізму агрегації.
- Виявлено, що Lys-плазміноген перешкоджає реорганізації актинового цитоскелету тромбоцитів, викликаної тромбіном та колагеном, що можна розглядати як один із механізмів антиагрегаційної дії Lys-плазміногену.
- Показано, що 6-аміногексанова кислота та кринглвмісні фрагменти плазміногену (К1-3, К4 та К5) перешкоджають інгібуванню Lys-плазміногеном агрегації тромбоцитів, тоді як інгібітор серинових протеїназ апротинін не виявляє подібного ефекту. Висловлено припущення про те, що антиагрегаційний ефект Lys-плазміногену обумовлений його взаємодією з мембраноасоційованими протеїнами тромбоцитів, які експонуються під час активації та беруть участь в процесі агрегації. Така взаємодія опосередкована лізинзв’язувальними сайтами кринглових доменів зимогену.
- З’ясовано, що препарати високо- та низькомолекулярних гепаринів не впливають на ADP-індуковану агрегацію тромбоцитів та антиагрегаційний ефект Lys-плазміногену в збагаченій тромбоцитами плазмі крові. Нефракціонований гепарин призводить до вивільнення РАІ-1 тромбоцитами в плазму крові.
{spoiler title=Список праць, опублікованих за темою дисертації opened=1}
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
- Рока-Мойя Я. Вплив екзогенного Ліз-плазміногену на АДФ-індуковану агрегацію тромбоцитів / Я. Рока-Мойя, Д. Жерносєков, Е. Золотарьова, Т. Гриненко // Вісник КНУ ім. Т. Шевченка. – 2011. – Біологія. № 58. – С. 34–46 (особистий внесок – отримання збагаченої тромбоцитами плазми крові людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену на агрегацію тромбоцитів людини методом агрегометрії).
- Рока-Мойя Я. М. Вплив плазміногену/плазміну на агрегаційну здатність тромбоцитів / Я. М. Рока-Мойя, Д. Д. Жерносєков, Т. В. Гриненко // Biopolimers and Cell. – 2012. – Vol. 28, № 5. – Р. 352–356 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та плазміну на агрегацію тромбоцитів людини методом агрегометрії).
- Рока-Мойя Я. М. Розробка та оптимізація методів визначення активності інгібітора активатора плазміногену 1-го типу в плазмі крові / Я. М. Рока-Мойя, Д. Д. Жерносєков, А. С. Кондратюк, Т. В. Гриненко // Український біохімічний журнал. – 2013. – Т. 85, № 4. – С. 111–118 (особистий внесок – виділення та очистка Glu-плазміногену людини та фібриногену бика, отримання мономерного desAB-фібрину бика, відпрацювання методу отримання фібринових плівок, відпрацювання методу визначення активності РАІ-1 із використанням фібринових плівок, відпрацювання амідолітичного методу визначення активності РАІ-1, написання статті, робота з рецензентами).
- Тихомиров А. О. Вплив Lys-форми плазміногену на реконструкцію актинового цитоскелету тромбоцитів / А. О. Тихомиров, Д. Д. Жерносєков, Я. М. Рока-Мойя, С. І. Діордієва, Т. В. Гриненко // Український фізіологічний журнал. – 2014. – Т. 60, № 1. – С. 25–33 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену на агрегацію тромбоцитів людини методом агрегометрії).
- Roka-Moya Y. M. Novel aspects of platelet aggregation / Y. M. Roka-Moya, V. L. Bilous, D. D. Zhernossekov, T. V. Grinenko // Biopolimers and Cell. – 2014. – Vol. 30, N 1. – P. 10–15 (особистий внесок – підбір та аналіз літератури, вивчення ефекту плазміногену на агрегацію тромбоцитів людини методом агрегометрії, статистичний аналіз отриманих даних).
- Roka-Moya Y. M. The study of the sites of plasminogen molecule which are responsible for inhibitory effect of Lys-plasminogen on platelet aggregation / Y. M. Roka-Moya, D. D. Zhernossekov, E. I. Yusova, L. G. Kapustianenko, T. V. Grinenko // Ukrainian Biochemical Journal. – 2014. – Vol. 86, N 5. – P. 80–87 (особистий внесок – дослідження впливу фрагментів плазміногену К1-3, К4, К5 на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, статистичний аналіз результатів агрегометрії та експериментів по вивченню зв’язування плазміногену та його фрагментів з актином).
- Пат. 98552 С2 Україна, МПК (2012.01), G01N 33/48 (2006/01), G01N 31/00. Спосіб визначення анти-ІІа-факторної активності низькомолекулярних гепаринів і тест-система для визначення анти-ІІа-факторної активності низькомолекулярних гепаринів на його основі / В. М. Рибачук, Л. П. Рясненко, Я. М. Рока-Мойя, С. М. Харченко, Т. В. Гриненко ; заявник і власник Інститут біохімії ім. О.В. Палладіна НАНУ. – Заявл. 16.11.10, опубл. 25.05.12, Бюл. № 10. – 6 с. (особистий внесок – налаштування програмного забезпечення до спектрофотометру «СФ-2000», відпрацювання та апробація турбідиметричного методу визначення анти-ІІа-факторної активності препаратів на основі низькомолекулярного гепарину, апробація методу).
- Жерносєков Д. Д. Пошук впливу плазміногену на агрегаційну здатність тромбоцитів / Д. Д. Жерносєков, Е. М. Золотарьова, Я. М. Рока-Мойя // Х Український біохімічний з’їзд, Одеса, Україна, 13-17 вересня 2010 р.: Український біохімічний журнал. – 2010. – Т. 82, № 4 (додаток 1). – С. 66 (отримання збагаченої тромбоцитами плазми крові людини, виділення та очистка препаратів Glu- та Lys-форм плазміногену людини).
- Рока-Мойя Я. М. Вплив екзогенного Ліз-плазміногену на агрегацію тромбоцитів / Я.М. Рока-Мойя // «Біологія: від молекули до біосфери»: VI Міжнародна конференція молодих науковців, Харків, Україна, 21-24 листопада 2011 р.: матеріали конф. – Харків, 2011. – С. 64-65 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та плазміну на агрегацію тромбоцитів людини методом агрегометрії).
- Рока-Мойя Я. М. Вплив компонентів плазміноген-плазмінової системи на агрегацію та секрецію тромбоцитів / Я. М. Рока-Мойя, Д. Д. Жерносєков, Т. В. Гриненко // «Молодь та поступ біології»: VIII Міжнародна наукова конференція студентів та аспірантів, Львів, Україна, 3-6 квітня 2012 р.: Збірник тез. – Львів, 2012. – С. 71-72 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та плазміну на агрегацію тромбоцитів людини методом агрегометрії, визначення активності РАІ-1 в продуктах секреції тромбоцитів).
- Рока-Мойя Я. М. Метод определения анти-ІІа факторной активности низкомолекулярных гепаринов / Я. М. Рока-Мойя, В. Н. Рыбачук, С. М. Харченко, Т. В. Гриненко // «Молодые ученые в решении актуальных проблем науки»: III Научно-практическая конференция, Владикавказ, РФ, 18-20 мая 2012 г.: Материалы конференции, Часть 1. – Владикавказ, 2012. – С. 254–257 (особистий внесок – налаштування програмного забезпечення до спектрофотометру «СФ-2000», відпрацювання та апробація турбідиметричного методу визначення анти-ІІа-факторної активності препаратів на основі низькомолекулярного гепарину, написання статті).
- Roka-Moya Y.M. Inhibitory effect Lys-plasminogen on washed platelet aggregation induced by different agonists / Y. M. Roka-Moya, D. D. Zhernossekov, T. V. Grinenko // Aktualne problemy nowoczesnych nauk, Przemysl, Polska, 07-15 czerwca 2012: Materiały konferencji. – 2012. – Volume 40. Nauk biologicznych. Rolnictwo. Weterynaria. – Przemysl, Nauka i studia. – S. 20–27 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та плазміну на агрегацію тромбоцитів людини методом агрегометрії).
- Рока-Мойя Я. М. Влияние Лиз-плазминогена на агрегацию и секрецию тромбоцитов / Я. М. Рока-Мойя, А. А. Тихомиров, Т. В. Гриненко // «Экспериментальная и теоретическая биофизика»: Международная конференция молодых ученых, Пущино, РФ, 22‐24 октября 2012г.: Сборник тезисов. – 2012. – С. 47 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та плазміну на агрегацію тромбоцитів людини методом агрегометрії, визначення активності РАІ-1 в продуктах секреції тромбоцитів).
- Рока-Мойя Я. М. Роль каталітичного домену та лізин-зв’язуючих сайтів Ліз-плазміногену у забезпеченні його інгібувального ефекту на агрегацію тромбоцитів / Я. М. Рока-Мойя, В. Л. Білоус // «Біологія: від молекули до біосфери»: VIІ Міжнародна конференція молодих науковців, Харків, Україна, 20-23 листопада 2012 р.: Матеріали конф. – Харків, 2012. – С. 58 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка препаратів плазміногену людини, вивчення ефекту 6-АГК та апротиніну на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, визначення активності РАІ-1 в продуктах секреції тромбоцитів).
- Білоус В. Л. Ефекти плазміногену та гепарину на агрегацію та секрецію тромбоцитів / В. Л. Білоус, Я. М. Рока-Мойя, Д. Д. Жерносєков // «Молодь та поступ біології»: ІХ Міжнародна наукова конференція студентів та аспірантів, Львів, Україна, 16-19 квітня 2013 р.: Збірник тез. – Львів, 2013. – С. 32 (особистий внесок – виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та гепарину на агрегацію тромбоцитів людини методом агрегометрії, визначення активності РАІ-1 в продуктах секреції тромбоцитів, статистичний аналіз, написання тез).
- Рока-Мойя Я.М. Про механізм інгібувального ефекту Lys-плазміногену на агрегацію тромбоцитів людини / Я. М. Рока-Мойя, Д. Д. Жерносєков, Т. В. Гриненко // Конференція-конкурс молодих учених «Актуальні проблеми біохімії та біотехнології», Київ, Україна, 6-7 червня 2013 р.: Український біохімічний журнал. – 2013. – Т. 85, № 4. – С. 147 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка препаратів плазміногену людини, дослідження впливу кринглових фрагментів плазміногену та препаратів гепарину на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, статистичний аналіз даних).
- Рока-Мойя Я.М. Влияние антикоагулянтных препаратов на основе гепарина на агрегацию и секрецию тромбоцитов / Я. М. Рока-Мойя, Д. Д. Жерносеков, В. Н. Рыбачук, Т. В. Гриненко // «Молодые ученые в решении актуальных проблем науки»: IV Научно-практическая конференция, Владикавказ, РФ, 17-18 июня 2013 г.: Материалы конференции, Часть 1. – Владикавказ, 2013. – С. 247–251 (особистий внесок – отримання інтактних тромбоцитів людини, дослідження ефектів НГ, НМГ та фондапаринуксу на агрегацію тромбоцитів людини методом агрегометрії, визначення активності РАІ-1 в продуктах секреції тромбоцитів амідолітичний методом, статистичний аналіз даних, написання статті).
- Mytropan M. P. Lys-plasminogen, but not Glu-form, inhibits reorganization of actin cytoskeleton in platelets / M. P. Mytropan, Y. M. Roka-Moya, S. I. Diordieva, Y. P. Shtal, A. A. Tykhomyrov // «Биология – наука ХХI века»: XVII Международная Пущинская школа-конференция молодых учених, Пущино, РФ, 21-26 июня 2013: Материалы конф. – 2013. – С. 171–172 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену на агрегацію тромбоцитів людини методом агрегометрії).
- Roka-Moya Y. M. Effect of Lys-plasminogen on platelet functions / Y. M. Roka-Moya, D. D. Zhernossekov, T. V. Grinenko // 38th FEBS Congress, Saint Petersburg, Russia, Julу 6-11 2013: FEBS Journal. – 2013. – Vol. 280, Sup. 1. – P. 195 (особистий внесок – отримання інтактних тромбоцитів людини, виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та його кринглвмісних фрагментів на агрегацію тромбоцитів людини методом агрегометрії, визначення активності РАІ-1 в релізатах активованих тромбоцитів амідолітичний методом, статистичний аналіз даних).
- Білоус В. Л. Вплив плазміногену та його фрагментів на агрегаційну здатність тромбоцитів / В. Л. Білоус, Я. М. Рока-Мойя, Д. Д. Жерносєков, О. І. Юсова, Л. Г. Капустяненко, Т. В. Гриненко // «Актуальні проблеми сучасної біохімії та клітинної біології»: 2-га Міжнародна наукова конференція, м. Дніпропетровськ, Україна, 24-25 вересня 2013: Матеріали конференції. – 2013. – С. 76 (особистий внесок – виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту плазміногену та його кринглвмісних фрагментів на агрегацію тромбоцитів людини методом агрегометрії, статистичний аналіз отриманих даних).
- Roka-Moya Y.M. Plasminogen kringle 5 abolishes the inhibitory effect of Lys-plasminogen on platelet aggregation / Y. M. Roka-Moya, L. G. Kapustianenko, D. D. Zhernossekov, E. I. Yusova, T. V. Grinenko // IX Jakub K. Parnas Conference «Proteins from birth to death», Jerusalem, Israel, 29 September – 2 October 2013: Program&Abstract Book, P65. – 2013. – P. 94 (особистий внесок – виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення ефекту фрагменту К5 плазміногену на агрегацію тромбоцитів людини методом агрегометрії, статистичний аналіз отриманих даних).
- Bilous V.L. Concerning the mechanism of inhibitory effect of Lys-plasminogen on the aggregation of human platelets /// «Adaptation Strategy of the Living Systems»: International Interdisciplinary Conference, Novy Svet, Ukraine, 12-17 May 2014: Abstract Book. - Kyiv: VS Martynyuk Publisher, 2014 . – Р. 4-5 (особистий внесок – виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення впливу кринглових фрагментів на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, статистичний аналіз отриманих даних).
- Рока-Мойя Я. М. Разработка и валидация метода определения активности ингибитора активатора плазминогена 1 типа в плазме крови / Я. М. Рока-Мойя, В. Л. Билоус, Д. Д. Жерносеков, В. Н. Рыбачук, Т. В. Гриненко // «Молодые ученые в решении актуальных проблем науки»: V Научно-практическая конференция, Владикавказ, РФ, 18-21 июня 2014 г.: Материалы конференции. – Владикавказ, 2014. – С. 176–179 (особистий внесок – виділення та очистка Glu-плазміногену людини та фібриногену бика, отримання мономерного desAB-фібрину бика, відпрацювання та визначення валідаційних характеристик амідолітичного методу визначення активності РАІ-1, написання статті).
- Roka-Moiia Y. M. Mechanism of inhibition of human platelet aggregation by Lys-plasminogen / Y. M. Roka-Moiia, D. D. Zhernossekov // І Congress «ВІО 2014», Warsaw, Poland, September 9-12 2014: Acta Biochimica Polonica – 2014. – Vol. 61, Supplement 1. – P. 159 (особистий внесок – виділення та очистка Glu- та Lys-форм плазміногену людини, вивчення конкурентного впливу кринглових фрагментів на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, статистичний аналіз отриманих даних).
- Рока-Мойя Я. М. Роль доменів плазміногену у забезпеченні інгібування Lys-плазміногеном агрегації тромбоцитів / Я. М. Рока-Мойя, В. Л. Білоус, Л. Г. Капустяненко, Д. Д. Жерносеков // ХІ Український біохімічний з’їзд, Київ, Україна, 6-10 жовтня 2014 р.: Український біохімічний журнал. – 2014. – Т. 86, № 5 (додаток 1). – С. 76 (особистий внесок – вивчення конкурентного впливу кринглових фрагментів на антиагрегаційний ефект Lys-плазміногену методом агрегометрії, статистичний аналіз отриманих даних, написання тез).
{/spoiler}
АНОТАЦІЯ
Рока-Мойя Я.М. Регуляція агрегації тромбоцитів плазміноген/плазміновою системою. – На правах рукопису.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 00.03.04 – біохімія. – Інститут біохімії ім. О.В. Палладіна НАН України, Київ, 2015.
Дисертаційна робота присвячена дослідженню регуляторних взаємодій між плазміноген/плазміновою системою та тромбоцитарною ланкою гемостазу. Встановлено, що тромбоцити залучаються до регуляції активності плазміноген/плазмінової системи. Вони накопичують та вивільняють значну кількість функціонально активного РАІ-1, що здатний ефективно пригнічувати процес активації плазміногену. Разом з тим, тромбоцити сприяють активації плазміногену та локальній генерації плазміну, про що свідчить зниження Km реакції активації плазміногену tPA за присутності інтактних та тромбін-активованих тромбоцитів.
Доведено, що плазміноген/плазмінова система регулює функціональний стан тромбоцитів. Виявлено, що Lys-плазміноген, який може утворюватися на тромбоцитарній поверхні, чинить потужну антиагрегаційну дію та перешкоджає агоніст-індукованій реорганізації актинового цитоскелету тромбоцитів, що розглядається як один із механізмів його антиагрегаційної активності. Отримані результати дозволяють стверджувати, що антиагрегаційний ефект Lys-плазміногену обумовлений його взаємодією з мембраноасоційованими протеїнами тромбоцитів, що експонуються під час активації та беруть участь в процесі агрегації. Обмеження агрегаційної здатності тромбоцитів плазміноген/плазміновою системою свідчить про її залучення до регуляції процесу тромбоутворення.
Ключові слова: агрегація тромбоцитів, плазміноген/плазмінова система,
Lys-плазміноген, інгібітор активатора плазміногену, актиновий цитоскелет, гепарин.
АННОТАЦИЯ
Рока-Мойя Я.М. Регуляция агрегации тромбоцитов плазминоген/плазминовой системой. – На правах рукописи.
Диссертация на соискание ученой степени кандидата биологических наук по специальности 03.00.04 – биохимия. – Институт биохимии им. А.В. Палладина НАН Украины, Киев, 2015.
Диссертационное исследование посвящено изучению реципрокных регуляторных взаимодействий между протеинами плазминоген/плазминовой системы и тромбоцитами. Установлено, что тромбоциты непосредственно вовлекаются в регуляцию активности плазминоген/плазминовой системы. Они выступают поверхностью для активации плазминогена и локальной генерации плазмина, а также секретируют активную форму ингибитора активатора плазминогена 1 типа (РАІ-1), который подавляет процесс активации плазминогена. Экспериментально доказано, что плазминоген/плазминовая система регулирует функциональное состояние тромбоцитов, ограничивая их агрегационную способность.
В ходе сравнительного кинетического анализа показано, что тромбоциты способствуют активации плазминогена тканевым активатором плазминогена (tPA). В присутствии интактных и активированных тромбоцитов возрастает сродство tPA к субстрату плазминогену, о чем свидетельствует снижение Km реакции активации в 8 и 18 раз, соответственно. С использованием разработанного диссертантом метода определения активности РАІ-1 установлено, что тромбоциты являются депо активной формы РАІ-1, который высвобождается в плазму крови при агонист-индуцированной агрегации тромбоцитов и способен эффективно ингибировать процесс активации плазминогена tPA.
Впервые установлено, что Lys-плазминоген, в отличие от Glu-формы плазминогена и отдельных кринглсодержащих фрагментов плазминогена, селективно ингибирует агрегацию тромбоцитов человека, индуцированную ADP, тромбином и коллагеном, но не оказывает влияния на ристомицин-стимулированную агглютинацию тромбоцитов. Показано, что Glu-плазминоген специфично связывается с поверхностью активированных тромбоцитов и может преобразовываться в Lys-плазминоген.
Впервые установлено, что Lys-плазминоген препятствует агонист-индуцированной реорганизации актинового цитоскелета тромбоцитов, что рассматривается как один из механизмов антиагрегационного действия зимогена. Показано, что аналог лизина 6-аминогексановая кислота и фрагменты плазминогена (К1-3, К4 и К5) препятствуют ингибированию Lys-плазминогеном агрегации тромбоцитов, тогда как ингибитор сериновых протеиназ апротинин не оказывает подобного влияния. Предполагается, что антиагрегационый эффект Lys-плазминогена обусловлен его взаимодействием с мембраноассоциированными протеинами тромбоцитов, которые экспонируются при активации и принимают участие в агрегации. Взаимодействие Lys-плазминогена с протеинами тромбоцитарной поверхности опосредованно лизинсвязывающими сайтами крингловых доменов зимогена. Таким образом, впервые установлено, что плазминоген/плазминовая система ограничивает агрегационную способность тромбоцитов и тем самым вовлекается в регуляцию процесса тромбообразования.
Изучалось влияние антикоагулянтных препаратов на основе гепарина на функциональное состояние тромбоцитов человека. Установлено, что при терапевтических концентрациях в плазме крови препараты гепарина не вызывают спонтанную агрегацию и не влияют на агрегацию тромбоцитов, стимулированную ADP. Вместе с тем, нефракционированный гепарин может индуцировать умеренную активацию тромбоцитов и высвобождение тромбоцитами РАІ-1 в плазму крови. Показано, что нефракционированный гепарин, низкомолекулярный гепарин и пентасахарид фондапаринукс не влияют на эффекты Glu- и Lys-плазминогена на ADP-индуцированную агрегацию тромбоцитов.
Разработан количественный метод определения активности РАІ-1 с использованием desAB-фибрина быка как стимулятора активации плазминогена. Показано, что предложенный метод характеризуется высокой точностью, воспроизводимостью, специфичностью и позволяет определять уровень активной формы РАІ-1 в плазме крови и тромбоцитах. Предложенный метод может быть использован в лабораторно-клинической практике для оценки уровня функционально активного РАІ-1 в плазме крови пациентов при диагностике и прогнозировании тромботических осложнений при сердечнососудистых заболеваниях.
Разработан способ определения анти-ІІа-факторной активности препаратов низкомолекулярного гепарина турбидиметрическим методом с использованием плазмы крови как источника антитромбина и фибриногена. Данный способ и тест-система на его основе могут быть использованы в фармацевтической промышленности для контроля качества субстанций и готовых лекарственных форм препаратов гепарина.
Результаты диссертационного исследования позволяют утверждать, что тромбоциты непосредственно вовлекаются в регуляцию активности плазминоген/
плазминовой системы, а плазминоген/плазминовая система регулирует функциональное состояние тромбоцитов, ограничивая их агрегационную способность.
Ключевые слова: агрегация тромбоцитов, плазминоген/плазминовая система, Lys-плазминоген, ингибитор активатора плазминогена, актиновый цитоскелет, гепарин.
SUMMARY
Roka-Moiia Ya. M. Regulation of platelet aggregation by plasminogen/plasmin system. – Manuscript.
PhD thesis by specialty 03.00.04 – Biochemistry. – Palladin Institute of Biochemistry, National Academy of Sciences of Ukraine, Kyiv, 2015.
The thesis is devoted to the investigation of regulatory interactions between plasminogen/plasmin system and platelet link of haemostasis. It was established that platelets were involved into regulation of activity of plasminogen/plasmin system. They accumulate and release the essential amount of functionally active PAI-1, which can efficiently inhibit plasminogen activation. At the same time platelets promote plasminogen activation and local plasmin generation, that is proved by the decrease of Km in the reaction of plasminogen activation by tPA in the presence of intact or thrombin-activated platelets.
It was proved that plasminogen/plasmin system regulates the functional state of platelets. It was shown that Lys-plasminogen, which can be formed on the platelet surface, possesses the potent antiaggregatory effect and prevent agonist-induced reorganization of actin cytoskeleton of platelets. It may be considered as one of the possible mechanisms of its antiaggregatory activity. The obtained results let us conclude that antiaggregatory effect of Lys-plasminogen is due to its interaction with platelet membrane-associated proteins, which are exposed during the activation and take part into aggregation. The limiting platelet aggregation ability by plasminogen/plasmin system proves its implication into the regulation of thrombus formation.
Key words: platelet aggregation, plasminogen/plasmin system, Lys-plasminogen, plasminogen activator inhibitor, actin cytoskeleton, heparin.
ВІДГУК
на дисертаційну роботу Рока-Мойя Яни Маріовни «РЕГУЛЯЦІЯ АГРЕГАЦІЇ ТРОМБОЦИТІВ ПЛАЗМІНОГЕН/ПЛАЗМІНОВОЮ СИСТЕМОЮ», представлену на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.04 – біохімія. (ВІДГУК1- pdf,ВІДГУК2- pdf )

